Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Тема: ВОДА – растворитель. Растворимые и нерастворимые в воде вещества. . Познание мира
Задачи: 1. совершенствовать знания о воде, о ее значении; 2. показать на опытах, какие вещества растворяются и не растворяются; 3. подвести к выводу о значении воды для живой природы; 4. совершенствовать навыки анализа и обобщения учащимися полученных знаний; 5. воспитание бережного отношения к воде. 6. Умение работать в сотрудничестве; Цель: Познакомить со свойством воды – растворимость;
Отгадай загадку ВОДА Я и туча, и туман, И ручей, и океан, И летаю, и бегу, И стеклянной быть могу! ВОДА
Свойства воды 1. Прозрачна 2. Бесцветна 3. Без запаха 4. Вода течёт. (свойство – текучесть) 5 . Без формы
Вода в природе может находиться в трёх состояниях Жидкое Твёрдое Газообразное вода рек, океанов, морей дождь роса град лёд снег иней пар
Песок Сахар Глина Соль
Мы привыкли, что вода - Наша спутница всегда. Без нее нам не умыться, Не наесться, не напиться. Смею я вам доложить, Без нее нам не прожить. Роль воды в природе
Люди, берегите воду!
По теме: методические разработки, презентации и конспекты
Вода. методы определения состава воды.Вода в природе, способы ее очистки.
Разработка урока химии в 8 классе, для учащихся обучающихся по программе Рудзитиса Г.Е., Фельдмана Ф.Г. материал урока включает элементы исследовательской деятельности учащихся. к уроку разработ...
В презентации сделано введение в тему урока, собран интересный дополнительный материал по теме, тест по изученному материалу....
Внеклассное мероприятие "Вода. Вода. Кругом вода..."
Цель мероприятия: повысить уровень информированности учащихся 8-ых классов в вопросе защиты воды как важнейшего природного источника жизнеобеспечения человека. Информация о значении воды, содержании е...
1 слайд

2 слайд
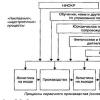
Растворы (дисперсные системы) Растворы – это физико-химические дисперсные системы состоящие из двух или более компонентов.

3 слайд
Дисперсная система, фаза, среда В растворах частицы одного вещества равномерно распределены в другом веществе, возникает дисперсная система. Растворенное вещество называется дисперсной фазой, а веще ство, в котором распределена дисперсная фаза, - дисперсионной средой(растворитель).

4 слайд
По величине частиц дисперсной фазы растворы разделяют на: Грубодисперсные системы(взвеси) – это гетерогенные системы (неоднородные). Размеры частиц этой фазы от 10⁻⁵ до 10⁻⁷м. Не устойчивы и видны невооруженным глазом (суспензии, эмульсии, пены, порошки).

5 слайд
По величине частиц дисперсной фазы растворы разделяют на: Коллоидные растворы(тонкодисперсные системы или золи) – это микрогетерогенные системы. Размер частиц от 10⁻⁷ до 10⁻⁹м. Частицы уже не видны невооруженным глазом, но система не устойчивая. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.

6 слайд
По величине частиц дисперсной фазы растворы разделяют на: Истинные растворы (молекулярнодисперсные и ионнодисперсные системы). Они не видны невооруженным глазом. Размеры частиц составляют 10ˉ8 см, т.е. равны размерам молекул и ионов. В таких системах гетерогенность исчезает - системы становятся гомогенными и устойчивыми, образуются истинные растворы. К ним относятся растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов.

7 слайд
Растворимость Растворимость – способность данного вещества растворятся в данном растворителе и при данных условиях. Растворимость зависит от нескольких факторов: от природы растворителя и растворенного вещества; от температуры; от давления. Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными молекулами. Хуже будет растворять с большей полярностью. И практически не будет с ионным типом связи.

8 слайд
Растворимость К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ, эфир, жиры, масла.

9 слайд
Растворимость газов Растворимость газов в жидкостях увеличивается с повышением давления и понижением температуры. При нагревании растворимость газов уменьшается, а кипячением можно полностью добиться освобождения раствора от газа. Газы лучше растворимы в неполярных растворителях.

10 слайд
Растворимость жидкости Растворимость жидкости в жидкости увеличивается с повышением температуры и практически не зависти от давления. В системах жидкость-жидкость, когда имеет место ограниченную растворимость 1 жидкости во 2 и 2 в 1, наблюдается расслаивание. При повышении температуры растворимость возрастает и при некоторых температурах происходит полное взаимное растворение этих жидкостей. Эта температура называется критичной температурой растворения и выше нее расслаивание не наблюдается.

11 слайд
Растворимость твердых веществ Растворимость твердых веществ в жидкостях мало зависит от температуры и не зависти от давления. Жидкость является растворителем, может растворять вещества до тех пор пока не достигается определенная концентрация, которая не может быть увеличена, как бы долго не происходил контакт между растворителем и растворенным веществом. Достижение таким образом равновесия, раствор называется насыщенным.

12 слайд
Раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество, называется ненасыщенным раствором. Раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок, называется пересыщенным раствором.

13 слайд
Гидратная теория Менделеева К концу 19 века сформировались 2 противоположные точки зрения на природу раствора: физическая и химическая Физическая теория рассматривала растворы, как смеси образовавшиеся в результате дробления растворимого вещества в среде растворителя без химического воздействия между ними. Химическая теория рассматривала процесс образования растворов, как химическое взаимодействие молекул растворяемого вещества и молекул растворителя.

14 слайд
Гидратная теория Менделеева Молекулы жидкого растворителя вступают в сольватацию взаимодействия с молекулами растворенного вещества имеющего кристаллическую решетку. Сольватация – процесс взаимодействия молекул растворителя и растворяемого вещества. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольвиоза объединение однородных частиц в растворе называют ассоциацией.
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Разработала: учитель биологии высшей категории Павленко Наталья Рафиковна 2014г. Муниципальное бюджетное образовательное учреждение «С редняя школа №4 » г. Щекино Тульской области Вода-растворитель. Работа воды в природе. урок природоведения в 5 классе
Цели: Образовательные: познакомить учащихся со свойствами воды как растворителя, научить приготавливать раствор соли в воде и взвесь мела в воде, формирование знаний о созидательной и разрушительной работе воды в природе. Развивающие: развитие мыслительных операций анализа и синтеза, развитие познавательной активности посредством работы с книгой и таблицами, научить делать выводы; развитие творческих способностей, развитие речи. Воспитательные: воспитание патриотизма (путем использования регионального компонента), формирование у школьников экологической культуры, не позволяющей приносить вред природе путем загрязнения водоемов.
Тема урока: Вода-растворитель. Работа воды в природе.
6 групп учащихся класса провели исследования воды
Географы (исследовали состав вод Мирового океана) Океанская вода - универсальный однородный ионизированный раствор, в состав которого входят 75 химических элементов. Это твердые минеральные вещества (соли), газы, а также взвеси органического и неорганического происхождения.
Юные натуралисты (исследовали дистиллированную воду) Дистиллированную воду получают перегонкой в специальных аппаратах - дистилляторах. Даже в ней - очищенной воде содержатся небольшие частички примесей и посторонних включений.
Химики (исследовали свойства питьевой воды в г.Щекино) В Тульской области железо является природным компонентом подземных вод. Кроме того, концентрация железа повышается при коррозии стальных и чугунных водопроводных труб.
Экологи (исследовали «серебряную воду») Вода, налитая в серебряные сосуды долго не портится. В ней содержатся ионы серебра, которые губительно действуют на бактерии, находящиеся в воде.
Биологи (исследовали содержание воды в организме человека и растений)
Диетологи (исследовали минеральную воду «Краинскую» на содержание солей и углекислого газа)
Вывод: Чистой воды в природе нет.
Лабораторная работа № 4 «Приготовление раствора соли и взвеси мела в воде». Цели: научиться приготавливать раствор и взвесь, научиться работать с лабораторным оборудованием. Оборудование: лоток, 2 стаканчика с водой, баночка № 1 с солью, баночка № 2 с мелом. Ход работы: 1.Придвиньте к себе лоток с реактивами. 2.Возьмите стаканчик с водой и баночку № 1. Зачерпните ложечкой соль. Насыпьте соль в стакан с водой и перемешайте ложечкой. Что Вы наблюдаете? Что произошло с солью? 3.Возьмите второй стаканчик с водой и баночку № 2. Зачерпните ложечкой мел. Насыпьте его в стакан с водой, перемешайте ложечкой. Что произошло с мелом? Что Вы наблюдаете? 4. Сравните результаты опытов с солью и мелом. Чем раствор отличается от взвеси? Что такое раствор? Вывод:
Вывод: Раствор - жидкость, содержащая посторонние вещества, которые в ней равномерно распределены.
Созидательная работа воды Вода-среда обитания организмов
Созидательная работа воды Вода- источник энергии
Созидательная работа воды Транспортные пути
Созидательная работа воды Образование плодородного ила
Созидательная работа воды При прорастании семян
Разрушительная работа воды Образование пещер
Разрушительная работа воды Наводнения
Разрушительная работа воды Цунами
Разрушительная работа воды Образование оврагов
Вывод: Работа воды в природе может быть созидательной и разрушительной.
Заполните таблицу (используя текст параграфа учебника) Созидательная работа воды Разрушительная работа воды
Домашнее задание П. 23 Напишите небольшое сочинение на тему: «Значение воды в природе и жизни человека».
Спасибо за внимание!
Список использованной литературы: Пакулова В.М., Иванова Н.В. «Природоведение. Природа. Неживая и живая» М.: «Дрофа» 2013 г. Ихер Т. П., Шиширина Н. Е., Тарарина Л.Ф. «Экологический мониногинг объектов водной среды» Методическое пособие для педагогов, студентов, и школьников., Тула: ТОЭБЦу, изд-во «Гриф и Кº», 2003 г. Мазур В.С. «Экология Щекинского района Тульской области», Щекино 1997
«Массовая доля вещества» - Плотность. Обозначают Vm . Мср = ?1 M1 + ?2 M2 + ?3 M3 + … объемная доля? = V1 / Vобщ. Обозначается w. Рассчитывается в долях или процентах. Молярная концентрация: с (в-ва) = n(в-ва) / Vсистемы в моль/л. Относительная плотность рассчитывается в относительных единицах.). Плотность любого вещества рассчитывается по формуле? = m/V, измеряется обычно в г/мл или в г/л.
«Ферромагнитная жидкость» - Ферромагнитная жидкость – «умная» жидкость. Применение: преобразование энергии колебательного движения в электрическую. Видео. МАОУ Сибирский лицей. “Меня вдохновляет сама жизнь, сама природа. Применение: электронные устройства. Ферромагнитная жидкость способна снижать трение. Применение: магнитная сепарация руд.
«Магнитные свойства вещества» - Ферриты обладают высоким значениями намагниченности и температурами Кюри. где – коэффициент пропорциональности, характеризующий магнитные свойства вещества и называемый магнитной восприимчивостью среды. У некоторых материалов магнитные свойства сохраняются и в отсутствие внешнего магнитного поля. Магнитный момент электрона и атома Атом во внешнем магнитном поле.
«Строение вещества молекулы» - CH3OH + HBr. CH3?CH2?NO2. Взаимное влияние атомов в молекулах на примере анилина. + 2Na. CH3OH + NaOH. С2н6. CH4. HC?C?CH2?CH3. Структурная. Изомеры -. 2-е положение. Теория химического строения А.М. Бутлерова. Увеличение основных свойств.
«Дисперсные системы» - Аэрозоли. По агрегатному состоянию дисперсионной среды и дисперсной фазы. Дисперсионная среда: Студенистые осадки, образующиеся при коагуляции золей. Нажмите любую клавишу. Гели. Природная вода всегда содержит растворённые вещества. Классификация дисперсных систем. Растворы. Дисперсная фаза: Суспензии.
«Чистые вещества и смеси» - 1. Смесью являются: ? Выводы: Какие бывают смеси? Фильтрование. Фосфат кальция. Чистые вещества и смеси. ZnO, ZnCl2, H2O. SO3, MgO, CuO. Чистое вещество обладает постоянными физическими свойствами (tкип, tплав, ? и др.). Перегонка (дистилляция). Способы разделения смесей. Какими способами можно разделить смеси?
Всего в теме 14 презентаций