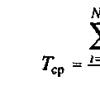1 слайд

2 слайд
Растворы (дисперсные системы) Растворы – это физико-химические дисперсные системы состоящие из двух или более компонентов.

3 слайд
Дисперсная система, фаза, среда В растворах частицы одного вещества равномерно распределены в другом веществе, возникает дисперсная система. Растворенное вещество называется дисперсной фазой, а веще ство, в котором распределена дисперсная фаза, - дисперсионной средой(растворитель).

4 слайд
По величине частиц дисперсной фазы растворы разделяют на: Грубодисперсные системы(взвеси) – это гетерогенные системы (неоднородные). Размеры частиц этой фазы от 10⁻⁵ до 10⁻⁷м. Не устойчивы и видны невооруженным глазом (суспензии, эмульсии, пены, порошки).

5 слайд
По величине частиц дисперсной фазы растворы разделяют на: Коллоидные растворы(тонкодисперсные системы или золи) – это микрогетерогенные системы. Размер частиц от 10⁻⁷ до 10⁻⁹м. Частицы уже не видны невооруженным глазом, но система не устойчивая. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.

6 слайд
По величине частиц дисперсной фазы растворы разделяют на: Истинные растворы (молекулярнодисперсные и ионнодисперсные системы). Они не видны невооруженным глазом. Размеры частиц составляют 10ˉ8 см, т.е. равны размерам молекул и ионов. В таких системах гетерогенность исчезает - системы становятся гомогенными и устойчивыми, образуются истинные растворы. К ним относятся растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов.

7 слайд
Растворимость Растворимость – способность данного вещества растворятся в данном растворителе и при данных условиях. Растворимость зависит от нескольких факторов: от природы растворителя и растворенного вещества; от температуры; от давления. Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными молекулами. Хуже будет растворять с большей полярностью. И практически не будет с ионным типом связи.

8 слайд
Растворимость К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ, эфир, жиры, масла.

9 слайд
Растворимость газов Растворимость газов в жидкостях увеличивается с повышением давления и понижением температуры. При нагревании растворимость газов уменьшается, а кипячением можно полностью добиться освобождения раствора от газа. Газы лучше растворимы в неполярных растворителях.

10 слайд
Растворимость жидкости Растворимость жидкости в жидкости увеличивается с повышением температуры и практически не зависти от давления. В системах жидкость-жидкость, когда имеет место ограниченную растворимость 1 жидкости во 2 и 2 в 1, наблюдается расслаивание. При повышении температуры растворимость возрастает и при некоторых температурах происходит полное взаимное растворение этих жидкостей. Эта температура называется критичной температурой растворения и выше нее расслаивание не наблюдается.

11 слайд
Растворимость твердых веществ Растворимость твердых веществ в жидкостях мало зависит от температуры и не зависти от давления. Жидкость является растворителем, может растворять вещества до тех пор пока не достигается определенная концентрация, которая не может быть увеличена, как бы долго не происходил контакт между растворителем и растворенным веществом. Достижение таким образом равновесия, раствор называется насыщенным.

12 слайд
Раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество, называется ненасыщенным раствором. Раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок, называется пересыщенным раствором.

13 слайд
Гидратная теория Менделеева К концу 19 века сформировались 2 противоположные точки зрения на природу раствора: физическая и химическая Физическая теория рассматривала растворы, как смеси образовавшиеся в результате дробления растворимого вещества в среде растворителя без химического воздействия между ними. Химическая теория рассматривала процесс образования растворов, как химическое взаимодействие молекул растворяемого вещества и молекул растворителя.

14 слайд
Гидратная теория Менделеева Молекулы жидкого растворителя вступают в сольватацию взаимодействия с молекулами растворенного вещества имеющего кристаллическую решетку. Сольватация – процесс взаимодействия молекул растворителя и растворяемого вещества. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольвиоза объединение однородных частиц в растворе называют ассоциацией.
В презентации «Вода. Растворы» представлен в полном объеме весь программный и дополнительный материал по теме «Вода. Растворы» в виде текстов, химических уравнений, схем, таблиц, рисунков, фото.
Наглядность, научность, системность, доступность в изложении материала в презентации дает возможность быстро и легко понять и усвоить содержание темы, систематизировать знания.
Презентация «Вода. Растворы» может быть использована на уроках химии при объяснении нового и повторении пройденного материала; при проверке знаний, умений и навыков у учащихся по теме «Вода. Растворы».
Презентация может быть использована учителем так же, как учебное электронное тематическое пособие, и во внеурочной работе - на занятиях дополнительного образования, спецкурсах и кружках, индивидуальных занятиях с учащимися; учащимися – при дистанционном обучении химии, при выполнении домашних заданий, самопроверке своих знаний по теме «Вода. Растворы», при подготовке к контрольным и практическим работам, а также - к ОГЭ и ЕГЭ.
Презентация «Вода. Растворы» предоставляет учителю возможность активизировать процесс обучения учащихся; дает большую возможность самостоятельного получения учащимися как программного, так и дополнительного объема знаний по теме, способствуя тем самым развитию их познавательных и аналитических способностей.
Тему «Вода. Растворы» учитель с учащимися может изучить на 4-5 уроках-семинарах с проведением лабораторных опытов, практической работы, показом видеофрагментов и (или) демонстрационных опытов, эффективно используя при этом материалы презентации.
С этой целью учитель предлагает учащимся самостоятельно, используя материалы презентации и других информационных источников, изучить дома конкретный материал по выбранному вопросу (вопросам), и обсудить его (их) совместно с классом и учителем на семинаре.
Вопросы к урокам-семинарам:
- Качественный и количественный состав воды (Слайды 15, 16)
- Решение расчетных задач по теме «Вода» (17, 18)
- Особенности строения воды (19, 24)
- Вода в природе. Физические ее свойства. Разновидности воды и льда (9-14, 28, 44, 45, 30)
- Уникальные свойства воды. Причины особых свойств воды (46-57)
- Химические свойства воды (57- 67)
- Экология воды. Возможные пути решения экологических проблем (93-109)
- Проблемы пресной воды. Перспективы их разрешения (110 -114)
- Роль воды в возникновении жизни на Земле. Биологическое значение воды для всего живого на Земле (83-92; 71-73)
- Планетарное значение Мирового океана (69)
- Использование воды в практической деятельности человека (78-80)
- Понятие о растворах. Классификация растворов по растворимости веществ в воде, степени их насыщенности и концентрации веществ в растворах (115)
- Растворимость веществ. Кривые растворимости. Способы выражения концентрации веществ (массовая доля растворенного вещества, молярная концентрация) (120-129)
- Решение расчетных задач по темам:
а) «Растворимость веществ»;
б) «Массовая доля растворенного вещества»;
в) «Молярная концентрация» (130-135) - Использование растворов в практической деятельности человека (117-119)
- Подготовка к ПР (практической работе) «Вода. Растворы» (136-145)
В соответствии с предложенными темами класс разбивается на группы, каждая из которых готовит вопросы и материал к изложению или обсуждению на уроке. Учитель предлагает учащимся для подготовки к семинару использовать соответствующие разделы учебника, презентацию «Вода. Растворы», Интернет-сеть.
Наиболее сложные, интересные и проблемные вопросы обсуждаются всем классом: процесс обучения вследствие чего активизируется.
На семинарах под руководством учителя необходимо рассмотреть наиболее значимые и трудные вопросы - № 2, 3 4, 5, 6,7, 8, 10,11, 12, 14.
При этом важно или необходимо:
- Установить причинно-следственную связь между строением воды и ее особыми свойствами
- Рассмотреть химические свойства воды
- Особо отметить биологическое значение воды и планетарное значение Мирового океана
- Обозначить экологические проблемы воды и возможности их разрешения
- Рассмотреть вопрос классификации растворов
- Рассмотреть из предложенных автором презентации образцов решения расчетных задач по теме «Вода. Растворы» (на вычисления по химическим формулам и уравнениям; на растворимость веществ, молярную концентрацию растворов, массовую долю растворенного вещества) наиболее сложные для учащихся
- Подготовить учащихся к выполнению практической работы «Вода. Растворы» (необходимо обсудить ход ее работы, ознакомить учащихся с методикой выполнения практической части работы, изучить вопросы техники безопасности в работе, познакомить учащихся с требованиями по оформлению практической работы)
На уроках-семинарах учитель в целом корректирует работу учеников, показывает демонстрационные опыты, видеофрагменты, знакомит учащихся с приемами правильного и безопасного обращении с лабораторным оборудованием и посудой с целью подготовки учащихся к выполнению практической работы.
Для проверки или самопроверки знаний по теме учитель или учащиеся могут использовать материалы «Вопросника» в «Приложении» презентации «Вода. Растворы».
Наличие такого электронного учебного пособия, как презентация «Вода. Растворы» дает возможность ученикам повысить заинтересованность учащихся в изучаемом материале, добиваться более высоких результатов в обучении по данной теме; сократить время учителя на подготовку к урокам.
Презентация имеет наглядное оформление; в ней используются эффекты анимации.
Разработанные автором данной статьи практические задания к практической работе, также, как и расчетные задачи к теме «Вода. Растворы», вопросы к урокам-семинарам и «Вопросник» для проверки и самопроверки знаний у учащихся по теме «Вода. Растворы» были апробированы учителем на практике с положительными результатами.
Презентация «Вода. Растворы» апробирована учителем и учениками не только на уроках химии, но и на занятиях дополнительного образования: с ее помощью были достигнуты более высокие результаты по качеству знаний у учащихся при изучении темы «Вода. Растворы».
«Вопросник» в «Приложении» презентации «Вода. Растворы» (с гиперссылками на слайды)
1. Как экспериментально можно подтвердить качественный и количественный состав воды? 15, 16
2. Какие особенности в строении молекулы воды вы знаете? 19, 20
3. Какие особенности строения воды как вещества вы можете отметить? 21 – 24
4. Какие уникальные свойства воды вам известны? 46 – 57
5. Почему лед легче воды? 48, 22, 27
6. Почему зимой водоемы не промерзают до дна? 48
7. За счет чего вода поддерживает определенный климат на Земле, в частности, его температурный режим? 49
8. Почему вода стала определяющим фактором в выработке теплокровности в мире живой природы в ходе биологической эволюции на Земле? 50
9. Почему на морозе стеклянная тара, наполненная водой, растрескивается? 28
10. Какие разновидности молекул воды вам известны? 30; 31–43 (фото)
11. Какую воду называют тяжелой? 44–45
12. Какую воду называют серебряной? Какими примечательными свойствами она обладает? 56
13. Перечислите с какими веществами может реагировать вода? 57–65
14. С какими металлами вода реагирует при обычных условиях? Приведите примеры 57
15. С какими металлами вода реагирует только при нагревании? Приведите примеры 57
16. С какими металлами вода не реагирует даже при нагревании? Приведите примеры 57
17. Известны ли вам реакции воды с неметаллами. Приведите примеры 58
18. Каково отношение воды к оксидам металлов? Приведите примеры 59
19. Каково отношение воды к оксидам неметаллов? Приведите примеры 60
20. Почему вода бесценна для всего живого на Земле? 69–72
21. Каково планетарное значение воды? (Возникновение жизни на Земле, фотосинтез, круговорот веществ в природе, поддержание определенного климата на Земле) 67–68
22. Какое значение имеет вода в практической деятельности человека? 76–79
23. В чем заключаются мировые экологические проблемы, связанные с водой? Можете ли вы обозначить пути их разрешения? 91 – 97
24. Почему воду надо экономить? Почему потребление пресной воды постепенно становится уже глобальной проблемой человечества? Имеет ли эта проблема возможности к разрешению ее? 107–108
25. Что вы понимаете под растворами? 112
26. Какой информацией вы располагаете о классификации растворов? 112
28. Какие способы выражения концентрации веществ в растворах вам известны? Какова суть каждого способа? 128–129; 133
29. Какие природные растворы наиболее значимы для человека? 113
30. Какое значение имеют растворы в практической деятельности человека? 114–116

Что же тогда такое раствор?
Раствор (истинный раствор) – гомогенная система, в которой размер частиц вещества меньше 1нм, между частицами и средой нет поверхности раздела.

Любой раствор состоит из:
- Растворенное вещество
- Растворитель
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.

Виды водных растворов
Вода + Твердое вещество
(CaCl 2 в H 2 O)
Вода + Жидкое вещество
(H 2 SO 4 в H 2 O)
Вода + Твердое вещество

Как происходит растворение?
Диффузия
Процесс проникновения одних молекул вещества, сквозь другие.
молекулы сахара (белые кружочки)
молекулами воды (темные кружочки)

Тепловые явления при растворении веществ
Разрушение химических и межмолекулярных связей между ионами, атомами или молекулами растворяющегося вещества и равномерное распределение (диффузия) образовавшихся частиц между молекулами воды.
затрата энергии
Эндотермический процесс
Взаимодействие частиц растворяемого вещества с растворителем.
выделение энергии
Экзотермический процесс

Растворение – это физико-химический процесс, в котором наряду с образованием обычной механической смеси веществ идет процесс взаимодействия частиц растворенного вещества с растворителем.

Растворимость
Растворимость – это способность веществ растворяться в воде или другом растворителе.
Вещества
Хорошо растворимые
Мало растворимые
Нерастворимые
Коэффициент растворимости (S) – максимальное число г вещества, которое может раствориться в 100 г растворителя при данной температуре.

Насыщенный раствор – это раствор, который находиться в динамическом равновесии с растворяющимся веществом.
- раствор, в котором данное вещество при данной температуре уже больше не растворяется
Факторы влияющие на растворимость
- Природа растворителя
- Природа растворяемого вещества
- Давление
- Температура

Концентрация раствора
Концентрация раствора – это содержание вещества в определенной массе или объеме раствора.

Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора.

Выражение концентрации раствора
Молярность – число молей растворенного вещества в 1 л раствора

Click to add Title
Click to add Title
Click to add Title
Click to add Title
Подобные документы
Понятие термина "оксиды" в химии, их классификация (твердые, жидкие, газообразные). Виды оксидов в зависимости от химических свойств: солеобразующие, несолеобразующие. Типичные реакция основных и кислотных оксидов: образование соли, щелочи, воды, кислоты.
презентация, добавлен 28.06.2015
Уравнения реакции Вант-Гоффа. Жидкие, газообразные и твердые растворы. Изучение механизмов растворения веществ. Проникновение молекул вещества в полость и взаимодействие с растворителем. Температура замерзания и кипения. Определение молекулярной массы.
презентация, добавлен 29.09.2013
Особенности растворов электролитов, сущность процесса образования раствора. Влияние природы веществ и температуры на растворимость. Электролитическая диссоциация кислот, оснований, солей. Реакции обмена в растворах электролитов и условия их протекания.
реферат, добавлен 09.03.2013
Агрегатные состояния вещества: кристаллическое, стеклообразное и жидкокристаллическое. Многокомпонентные и дисперсные системы. Растворы, виды и способы выражения их концентрации. Изменение энергии Гиббса, энтальпии и энтропии при образовании раствора.
реферат, добавлен 13.02.2015
Понятие инфузионных растворов, их обязательные свойства. Классификация инфузионных растворов и их назначение. Особенности коллоидных растворов, показания к их применению. Растворы декстранов, особенности их использования, а также возможные осложнения.
презентация, добавлен 23.10.2014
Сущность растворов как однородной многокомпонентной системы, состоящей из растворителя, растворённых веществ и продуктов их взаимодействия. Процесс их классификации и основные способы выражения состава. Понятие растворимости, кристаллизации и кипения.
реферат, добавлен 11.01.2014
Правила техники безопасности при работе в химической лаборатории. Понятие о химическом эквиваленте. Способы выражения состава растворов. Закон и фактор эквивалентности. Приготовление растворов с заданной массовой долей из более концентрированного.
разработка урока, добавлен 09.12.2012
Изучение влияния газовой атмосферы роста на параметры твердых растворов. Определение зависимости скорости роста эпитаксиальных слоев (SiC)1-x(AlN)х от парциального давления азота в системе. Состав гетероэпитаксиальных структур твердого раствора.
статья, добавлен 02.11.2018
Понятие дисперсной системы и истинного раствора. Термодинамика процесса растворения. Физические свойства растворов неэлектролитов, их коллигативные свойства. Характеристика первого закона Рауля и закона разбавления Оствальда для слабых электролитов.
презентация, добавлен 27.04.2013
Приобретение навыков приготовления растворов из сухой соли. Использование пипеток Мора. Применение бюреток, мерных цилиндров и мензурок при титровании. Определение плотности концентрированного раствора с помощью ареометра. Расчёт навески хлорида натрия.
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Разработала: учитель биологии высшей категории Павленко Наталья Рафиковна 2014г. Муниципальное бюджетное образовательное учреждение «С редняя школа №4 » г. Щекино Тульской области Вода-растворитель. Работа воды в природе. урок природоведения в 5 классе
Цели: Образовательные: познакомить учащихся со свойствами воды как растворителя, научить приготавливать раствор соли в воде и взвесь мела в воде, формирование знаний о созидательной и разрушительной работе воды в природе. Развивающие: развитие мыслительных операций анализа и синтеза, развитие познавательной активности посредством работы с книгой и таблицами, научить делать выводы; развитие творческих способностей, развитие речи. Воспитательные: воспитание патриотизма (путем использования регионального компонента), формирование у школьников экологической культуры, не позволяющей приносить вред природе путем загрязнения водоемов.
Тема урока: Вода-растворитель. Работа воды в природе.
6 групп учащихся класса провели исследования воды
Географы (исследовали состав вод Мирового океана) Океанская вода - универсальный однородный ионизированный раствор, в состав которого входят 75 химических элементов. Это твердые минеральные вещества (соли), газы, а также взвеси органического и неорганического происхождения.
Юные натуралисты (исследовали дистиллированную воду) Дистиллированную воду получают перегонкой в специальных аппаратах - дистилляторах. Даже в ней - очищенной воде содержатся небольшие частички примесей и посторонних включений.
Химики (исследовали свойства питьевой воды в г.Щекино) В Тульской области железо является природным компонентом подземных вод. Кроме того, концентрация железа повышается при коррозии стальных и чугунных водопроводных труб.
Экологи (исследовали «серебряную воду») Вода, налитая в серебряные сосуды долго не портится. В ней содержатся ионы серебра, которые губительно действуют на бактерии, находящиеся в воде.
Биологи (исследовали содержание воды в организме человека и растений)
Диетологи (исследовали минеральную воду «Краинскую» на содержание солей и углекислого газа)
Вывод: Чистой воды в природе нет.
Лабораторная работа № 4 «Приготовление раствора соли и взвеси мела в воде». Цели: научиться приготавливать раствор и взвесь, научиться работать с лабораторным оборудованием. Оборудование: лоток, 2 стаканчика с водой, баночка № 1 с солью, баночка № 2 с мелом. Ход работы: 1.Придвиньте к себе лоток с реактивами. 2.Возьмите стаканчик с водой и баночку № 1. Зачерпните ложечкой соль. Насыпьте соль в стакан с водой и перемешайте ложечкой. Что Вы наблюдаете? Что произошло с солью? 3.Возьмите второй стаканчик с водой и баночку № 2. Зачерпните ложечкой мел. Насыпьте его в стакан с водой, перемешайте ложечкой. Что произошло с мелом? Что Вы наблюдаете? 4. Сравните результаты опытов с солью и мелом. Чем раствор отличается от взвеси? Что такое раствор? Вывод:
Вывод: Раствор - жидкость, содержащая посторонние вещества, которые в ней равномерно распределены.
Созидательная работа воды Вода-среда обитания организмов
Созидательная работа воды Вода- источник энергии
Созидательная работа воды Транспортные пути
Созидательная работа воды Образование плодородного ила
Созидательная работа воды При прорастании семян
Разрушительная работа воды Образование пещер
Разрушительная работа воды Наводнения
Разрушительная работа воды Цунами
Разрушительная работа воды Образование оврагов
Вывод: Работа воды в природе может быть созидательной и разрушительной.
Заполните таблицу (используя текст параграфа учебника) Созидательная работа воды Разрушительная работа воды
Домашнее задание П. 23 Напишите небольшое сочинение на тему: «Значение воды в природе и жизни человека».
Спасибо за внимание!
Список использованной литературы: Пакулова В.М., Иванова Н.В. «Природоведение. Природа. Неживая и живая» М.: «Дрофа» 2013 г. Ихер Т. П., Шиширина Н. Е., Тарарина Л.Ф. «Экологический мониногинг объектов водной среды» Методическое пособие для педагогов, студентов, и школьников., Тула: ТОЭБЦу, изд-во «Гриф и Кº», 2003 г. Мазур В.С. «Экология Щекинского района Тульской области», Щекино 1997