Acid azotic.
Completat de: profesor de chimie și biologie
Muravyova Nina Ivanovna

- Oxizi de azot
- Structura moleculei de acid azotic.
- Prepararea acidului azotic
- Proprietăți fizice.
- Proprietățile nitraților.
- Experiment de laborator
- Aplicarea acidului azotic și a nitraților

Oxizi de azot
Masă
Comparația oxizilor de azot, acizilor și sărurilor
Amintiți-vă și scrieți formulele oxizilor de azot. Ce oxizi sunt numiți care formează sare, care sunt numiți care nu formează sare? De ce?

Structura moleculei de acid azotic.
Formula structurală a acidului azotic

Prepararea acidului azotic
În laborator NaNO 3 (TV.) + H 2 SO 4 (END) → NaHSO 4 + HNO 3
În industrie
4NH 3 + 5O 2 → 4NO + 6H 2 O + Q
2NO + O 2 → 2NO 2 (la răcire)
4NO 2 + O 2 + 2H 2 O ↔ 4HNO 3 + Q

Prepararea acidului azotic prin oxidarea amoniacului cu oxigenul atmosferic.
Amestecul amoniac-aer

Schema de producere a acidului azotic în industrie
2 NO2+O2 →2NO2
3NO2+H2O →2HNO3 +NO
catalizator
Dispozitiv de contact
Turnul de oxidare
Turn de absorbție

Dispozitiv de contact
Amoniac-aer
Catalizator
Gaze azotate

Proprietăți fizice
Acidul azotic pur este un lichid incolor, fumos, cu un miros puternic, iritant. Acidul azotic concentrat are de obicei o culoare galbenă. Această culoare îi este dată de oxidul de azot (IV), care se formează din cauza descompunerii parțiale a acidului azotic și se dizolvă în el.

- Acidul azotic este un agent oxidant puternic, acidul azotic concentrat oxidează sulful în acid sulfuric și fosforul în acid fosforic, unii compuși organici (de exemplu, amine și hidrazine, terebentină) se auto-aprinde la contactul cu acidul azotic concentrat.



Proprietățile nitraților
Eu sunt în stânga lui Mg
MeNO 2 + O 2 ↓
Eu sunt intre Mg si Cu
MeO + NO2 + O2
Eu sunt la dreapta lui Cu
Eu + NU 2 + O 2

- Adăugați cu grijă câteva bucăți subțiri de sârmă de cupru într-o eprubetă care conține acid azotic concentrat. Reacția are loc fără încălzire, elevii observă o schimbare a culorii soluției și eliberarea de gaz roșu-brun NO2

Testează-te
Cu + HNO 3 (SFÂRȘIT) = Cu(NR 3 ) 2 + NU 2 +H 2 O

- Adăugați cu grijă câteva bucăți subțiri de sârmă de cupru într-o eprubetă care conține acid azotic diluat. Reacția are loc atunci când este încălzită. Observați schimbarea culorii soluției și eliberarea de gaz NO incolor
- Scrieți o ecuație pentru reacția care are loc

Testează-te
Cu + HNO3(detaliat) = Cu(NO3)2 + NO + H2O
Cu 0 – 2e = Cu +1 3 agentul reducător este oxidat
N +5 + 3e = N +2 2 agentul de oxidare este redus
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O

Aplicarea acidului azotic și a nitraților
MEDICAMENTE
VOPSELE
COLODIU
EXPLOZIVI
FILM FOTO
AQUA REGIA
Îngrășăminte minerale

- De ce starea de oxidare a azotului în acidul azotic este +5, iar valența este de patru?
- Cu ce metale nu reacționează acidul azotic?
- Trebuie să recunoașteți acizii clorhidric și azotic, există trei metale pe masă - cupru, aluminiu și fier. Ce vei face și de ce?
Acid azotic și sărurile sale
Întocmit de profesorul de chimie al KOU VO „TsLPDO” Savrasova M.I.

Ține minte!
- Ce stări de oxidare prezintă azotul în oxizii săi?
- Ce oxizi de azot cunoașteți?
- Spune-ne despre N2O, NO, NO2?
- Care dintre acești compuși de azot este cel mai important din punct de vedere al valorii economice a producției?


- Studiul proprietăților acidului azotic,
- Semnificația sa în activitatea economică umană.

Structura moleculei
HNO3 – formula moleculara

Proprietățile fizice ale acidului azotic
- Examinați mostrele de acid azotic care vi se oferă.
- Verificați culoarea, transparența, solubilitatea în apă. Înregistrați-vă observațiile în caiet.

Proprietățile chimice ale acidului azotic
- Acid foarte puternic
- Se disociază în soluție apoasă:
- H NO3 ↔NO3 + H
- Interacționează:
- Cu metale
- Cu +4HNO3 = Cu(NO3)2 +2NO2 +2H2O
- Cu oxizi metalici:
- CuO + 2HNO3= Cu(NO3)2 +H2O
- Cu hidroxizi metalici
- Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O

Proprietăți speciale
- Cu +4HNO3 = Cu(NO3)2 +2NO2 +2H2O
- Când este încălzit, se eliberează un gaz maro, care este otrăvitor pentru oameni.
Reacție calitativă la ionii de nitrat

Producția de acid azotic
- Oxidarea azotului aerului.
- Oxidarea suplimentară a oxidului de azot +2 în oxid de azot +4
- Prepararea acidului azotic.
Scrieți ecuațiile pentru reacțiile corespunzătoare.

Aplicarea acidului azotic
Explozivi
Medicamente
Acid azotic
Fibre artificiale
Coloranți
Îngrășăminte

Nitrați
- NaNO3
- NH4NO3
- Ca(NO3)2
- Sărurile acidului azotic se mai numesc și nitrat. Sunt folosite la producerea de chibrituri, praf de pușcă și îngrășăminte.

Consolidare
- 2KNO3 →2KNO2 +O2
- Reacția calitativă la nitrați.
- Decide dacă propoziția care ți-a fost dată este corectă sau incorectă:
- 1. Acidul azotic este un lichid greu care este slab solubil în apă.
- 2. Acidul azotic este un lichid gălbui, foarte solubil în apă.

Consolidare
- 3. Acidul azotic formează săruri – nitriți.
- 4. Acidul azotic formează nitrați de sare.
- 5. În acidul azotic, azotul este +5.
- 6. În acidul azotic, azotul este +4.
- 7. Acidul azotic nu reacționează cu metalele după hidrogen.

Consolidare
8. Acidul azotic nu reacționează cu niciun metal.
9. Acidul azotic reacţionează cu oxizii metalici.
10. Acidul azotic reacţionează cu bazele.
11. Acidul azotic reacţionează cu sărurile.
12. Acidul azotic poate fi detectat prin reacția sa cu cuprul.
13. Acidul azotic poate fi recunoscut după interacțiunea cu cărbunele.

Testează-ți cunoștințele:
- Raspunsuri corecte:
- 1,4,5, 9,10,11,12.

Teme pentru acasă
§29 exerciţiile 1-4
„Acizi grași” - Lumenul vasului. TxA2. Impact fizic, trombina, TNFa, ROS, IL-1b. Acidul arahidonic și alți acizi grași polienici ca molecule de semnalizare. 3. 1. Lipidomica si lipidologie. 5o. Construcția sistemului. D 6 -desaturare. Enzime, proteine. n-6. S.D. Varfolomeev, A.T. Mevkh, P.V. Vrzheshch și colab.
„Acid azotic” - 2. Interacțiunea acidului azotic cu metalele. 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O. Acid azotic conform: Clasificarea acidului azotic (HNO3). N20. Scrieți ecuațiile pentru reacțiile acidului azotic: valența azotului. Interacțiunea acidului azotic cu metalele. Luați în considerare transformările în lumina OVR. 1. Oxidarea de contact a amoniacului la oxid de azot (II):
„Acidul carbonic și sărurile sale” - Răspunsuri corecte: opțiunea 1 – 1, 2, 3, 4, 8, 10 opțiunea 2 – 3, 5, 6, 7, 9, 10. Introduceți în diagramă. Despre ce fenomen vorbim? Foarte toxic Nu arde și nu susține arderea Utilizat în metalurgie la topirea fontei Se formează în timpul arderii complete a combustibilului Magneziul arde în el Oxid acid tipic.
„Producerea acidului sulfuric” - cuptor cu pat fluidizat. Curățare de praf mare. Acid sulfuric deasupra, oxid de sulf(VI) în partea de jos. Etapa II. H2SO4. Etapa I: Prăjirea piritei. 1. Combustie 2. Exotermă 3. Eterogene 4. Necatalitică 5. Ireversibilă 6. Redox. Instituția de învățământ municipală Școala secundară Navlinskaya Nr. 1 Profesor de chimie Kozhemyako G.S.
"Acid carbonic" - 14. t. 6. 7. 2NaOH. 11. Acidul carbonic corespunde: 16. 8.
„Lecția de acid sulfuric” - Efecte negative asupra mediului." Cum poți recunoaște acidul sulfuric? Care sunt proprietățile fizice ale acidului sulfuric? Ce stări de oxidare sunt caracteristice atomului de sulf? Scopul lecției: Ce indicatori pot detecta acizi? Motto-ul lecției : Aplicarea acidului sulfuric Ploaia acidă Cu ce metale reacționează acidul sulfuric concentrat?
1 tobogan
Acid azotic 1. Compoziție. Structura. Proprietăți fizice 2. Clasificare 3. Prepararea acidului azotic 4. Proprietăți chimice 5. Test de aplicare Săruri de acid azotic

2 tobogan
Compoziția HNO3. Structura. Proprietăți. H O N O O - - gradul de oxidare a azotului valența azotului +5 IV legătura chimică covalent polar Acidul azotic este un lichid higroscopic incolor, cu miros înțepător, „fum” în aer, solubil nelimitat în apă. fierbe. = 83ºC.. Când este depozitat la lumină, se descompune în oxid nitric (IV), oxigen și apă, dobândind o culoare gălbuie: 4HNO3 = 4NO2 + O2 + 2H2O Acidul azotic este otrăvitor.

3 slide

4 slide

5 slide
Acid azotic (HNO3) Clasificare în funcție de prezența oxigenului: bazicitate: solubilitate în apă: volatilitate: grad de disociere electrolitică: acid azotic puternic volatil monobazic solubil cu conținut de oxigen conform:

6 diapozitiv
Producerea acidului azotic în industrie NH3 NO NO2 HNO3 4NH3+ 5O2 = 4NO + 6H2O 2NO+O2 = 2NO2 4NO2 + 2H2O + O2 = 4HNO3 1. Oxidarea de contact a amoniacului în oxid azotic (II): 2. Oxidarea (II) a oxidului de azot la oxid nitric (IV): 3. Adsorbția (absorbția) oxidului de azot (IV) de către apă cu exces de oxigen

7 slide
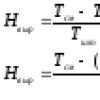
În laborator, acidul azotic este produs prin acțiunea acidului sulfuric concentrat asupra nitraților la încălzire scăzută. Scrieți o ecuație pentru reacția de producere a acidului azotic. NaNO3 + H2SO4 = NaHSO4 + HNO3

8 slide
Proprietățile chimice ale acidului azotic 1. Proprietățile tipice ale acizilor 2. Interacțiunea acidului azotic cu metalele 3. Interacțiunea acidului azotic cu nemetale

Slide 9
Proprietățile chimice ale acidului azotic Acidul azotic prezintă toate proprietățile tipice ale acizilor. Enumerați proprietățile caracteristice acizilor. Acizii interacționează cu oxizii bazici și amfoteri, cu bazele, hidroxizii amfoteri și cu sărurile. Alcătuiți ecuații pentru reacțiile acidului azotic: 1 3 2 cu oxid de cupru (II), oxid de aluminiu; cu hidroxid de sodiu, hidroxid de zinc; cu carbonat de amoniu, silicat de sodiu. Luați în considerare reacțiile dintr-o perspectivă. TED. Dați nume substanțelor rezultate. Determinați tipul de reacție. 3

10 diapozitive
2HNO3 + CuO = Cu(NO3)2 + H2O 1 2H+ + 2NO3– + CuO = Cu2+ + 2NO3– + H2O 2H+ + CuO = Cu2+ + H2O 6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O 6H+ + + Al 6O3 =– 2Al3+ + 6NO3– + 3H2O 6H+ + Al2O3 = 2Al3+ + 3H2O HNO3 + NaOH = NaNO3 + H2O H+ + NO3– + Na+ + OH– = Na+ + NO3– + H2O H+ + OH– = H2O 2 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O 2H+ + 2NO3– + Zn(OH)2 = Zn2+ +2NO3– + 2H2O 2H+ + Zn(OH)2 = Zn2+ + 2H2O

11 diapozitiv
3 2HNO3 + (NH4)2CO3 = 2NH4NO3 + CO2 + H2O 2H+ + 2NO3– + 2NH4+ + CO22– = 2NH4+ +2NO3– + CO2 + H2O 2H+ + CO22– = CO2 + H2O 2HNO3 + Na2SiO3SiO3 +NO3 +NO2 +NO2 +NO2 +NO2 + H2O2 – + 2Na+ + SiO32– = ↓H2SiO3 + 2Na+ + 2NO3– 2H+ + SiO32– = ↓H2SiO3 Acizii activi înlocuiesc acizii slabi volatili sau insolubili din soluțiile sărate.

12 slide
Interacțiunea acidului azotic cu metalele Cum reacționează metalele cu soluțiile acide? Metalele care se află în seria de activitate înainte ca hidrogenul să îl înlocuiască din acizi. Metalele care stau după hidrogenul din acizi nu îl înlocuiesc, adică. nu interacționează cu acizii, nu se dizolvă în ei. Caracteristici ale interacțiunii acidului azotic cu metalele: 1. Niciun metal nu eliberează vreodată hidrogen din acidul azotic. Se eliberează diverși compuși de azot: N+4O2, N+2O, N2+1O, N20, N–3H3 (NH4NO3) 2. Metalele care vin înainte și după hidrogen în seria de activități reacţionează cu acidul azotic. 3. Acidul azotic nu interacționează cu Au, Pt 4. Acidul azotic concentrat pasivează metalele: Al, Fe, Be, Cr, Ni, Pb și altele (datorită formării unui film dens de oxid). Când este încălzit și când acidul azotic este diluat, aceste metale se dizolvă în el. experiență experiență experiență N–3H4+ N20 N2+1O N+2O N+4O2 concentrație acidă activitate metalică

Slide 13

Slide 14
Scrieți o ecuație pentru reacția dintre acidul azotic concentrat și mercur. Luați în considerare reacția dintr-o perspectivă. OVR. 4HN+5O3 + Hg0 = Hg+2(NO3)2 + 2N+4O2 + 2H2O N+5 + 1e → N+4 1 2 Hg0 – 2e → Hg+2 2 1 HNO3 (datorită N+5) – agent oxidant , procesul de recuperare; Hg0 – agent reducător, proces de oxidare.

15 slide
Completați schemele de reacție: Considerați transformările în lumina ORR 1) HNO3(conc.) + Cu → Cu(NO3)2 + … + H2O 2) HNO3(dil.) + Cu → Cu(NO3)2 + … + H2O 1) HN +5O3(conc.) + Cu0 = Cu+2(NO3)2 + N+4O2 + H2O 2 2 N+5 + 1e → N+4 1 2 Cu0 – 2e → Cu+2 2 1 2) HN+5O3( conc.) + Cu0 = Cu+2(NO3)2 + N+2O + H2O 3 3 4 2 8 N+5 + 3e → N+2 3 2 Cu0 – 2e → Cu+2 2 3 oxidare de reducere agent reducător agent oxidant 4 reducere oxidare agent oxidant agent reducător

16 diapozitiv

Slide 17
Interacțiunea acidului azotic cu nemetale Oxidează nemetale la acizii corespunzători. Acidul azotic concentrat (mai mult de 60%) se reduce la NO2, iar dacă concentrația acidului este (15 - 20%), atunci la NO. HNO3 + С → СO2 + H2O + NO2 N+5 + 1e → N+4 1 4 С0 – 4e → С+4 4 1 4 4 2 HNO3 + P → H3PO4 + NO2 + H2O N+5 + 1e → N+4 1 5 P0 – 5e → P+5 5 1 5 2 5 HNO3 + P + H2O → H3PO4 + NO N+5 + 3e → N+2 3 5 P0 – 5e → P+5 5 3 3 5 3 5 Acid azotic ca agent oxidant puternic Aranjați coeficienții în diagrame folosind metoda balanței electronice. HNO3 (datorită N+5) – agent de oxidare, proces de reducere C – agent de reducere, proces de oxidare HNO3 (datorită de N+5) – agent de oxidare, proces de reducere P – agent de reducere, proces de oxidare HNO3 (datorită de N+5) – agent oxidant, proces de reducere P – agent reducător, experiență în procesul de oxidare

18 slide

Slide 19

20 de diapozitive
Aplicarea acidului azotic 1 5 4 6 2 3 Producția de azot și îngrășăminte complexe. Producția de explozivi Producția de coloranți Producția de medicamente Producția de filme, nitro-lacuri, nitro-emailuri Producția de fibre artificiale 7 Ca componentă a unui amestec de nitrare, pentru traularea metalelor în metalurgie

21 de diapozitive
Sărurile acidului azotic Cum se numesc sărurile acidului azotic? nitrați Nitrații K, Na, NH4+ se numesc nitrați Scrieți formulele pentru sărurile enumerate. KNO3 NaNO3 NH4NO3 Nitrații sunt substanțe cristaline albe. Electroliții puternici se disociază complet în ioni în soluții. Ei intră în reacții de schimb. Cum se poate determina ionul de nitrat în soluție? La sare (conținând ionul azotat) se adaugă acid sulfuric și cuprul. Amestecul se încălzește ușor. Eliberarea de gaz brun (NO2) indică prezența ionului de nitrat.
Slide 23
Substanță cristalină albă. Punctul de topire este de 169,6 °C când este încălzită peste această temperatură, începe descompunerea treptată a substanței și la o temperatură de 210 °C are loc descompunerea completă. azotat de amoniu

24 slide
Când sunt încălziți, nitrații se descompun cu atât mai complet, cu atât metalul care formează sarea se află mai în dreapta în seria tensiunii electrochimice. Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb Cu Ag Hg Au nitrit + O2 oxid de metal + NO2 + O2 Me + NO2 + O2 Scrieți ecuațiile pentru reacțiile de descompunere a azotatului de sodiu, azotatului de plumb și azotatului de argint. 2NaNO3 = 2NaNO2 + O2 2Pb(NO3)2= 2PbO + 4NO2 + O2 2AgNO3 = 2Ag + 2NO2 + O2

25 slide
1. Gradul de oxidare a azotului din acidul azotic este: A) +5; B) +4; B) -3. A 2. Când interacționează cu ce substanțe, acidul azotic prezintă proprietăți speciale care îl deosebesc de alți acizi: A) oxizi bazici; B) metale; B) motive. B 3. În reacţia redox, acidul azotic poate participa ca: A) agent de oxidare; B) agent reducător; B) un agent oxidant și un agent reducător. A 4. Care dintre acești compuși de azot se numește nitrat chilian: A) azotat de potasiu; B) azotat de calciu; B) azotat de sodiu; Q 5. Notați ecuația pentru interacțiunea cuprului cu acidul azotic concentrat. Coeficientul din fata formulei acide este: A) 2; B) 4; C) 1. B 6. Care dintre următoarele substanţe nu reacţionează cu acidul azotic diluat: A) cuprul; B) hidroxid de sodiu; B) bromură de sodiu. B 7. Acidul azotic se obține în trei etape, oxidând atomul de azot după următoarea schemă: A) N–3 →N+2 →N+4 → N+5 B) N–3 →N0 →N+4 → N+5 C) N0 →N+2 →N+4 → N+5 A
Lecție de chimie în clasa a IX-a. „Proprietăți oxidative ale acidului azotic”. Obiectivul lecției: Să se familiarizeze cu proprietățile speciale ale acidului azotic ca agent oxidant. Obiective: educaționale: luați în considerare proprietățile oxidative ale acidului azotic, observați interacțiunea acestuia cu metale și nemetale. Egalizarea reacțiilor redox care implică acid azotic folosind metoda echilibrului electronic; dezvoltarea: dezvoltarea în continuare a gândirii logice, a abilităților de a observa, analiza și compara, găsi relații cauză-efect, trage concluzii, lucrează cu algoritmi, dezvoltă interesul pentru subiect; educațional: pentru a forma viziunea științifică asupra lumii a elevilor; învață să-l asculți pe profesor și pe colegii tăi, să fii atent la tine și la ceilalți și să ții o conversație. Tipul de lecție: învățarea unui subiect nou
Descărcați:
Previzualizare:
Pentru a utiliza previzualizările prezentării, creați un cont Google și conectați-vă la el: https://accounts.google.com
Subtitrările diapozitivelor:
Proprietățile oxidative ale acidului azotic Profesor de chimie din categoria I de calificare MBOUSOSH nr. 4, Sovetsky Khanty-Mansi Autonomous Okrug-Yugra Kazantseva A. G.
Obiectivul lecției: Luați în considerare proprietățile oxidative ale acidului azotic, observați interacțiunea acestuia cu metale și nemetale. Egalizarea reacțiilor redox care implică acid azotic utilizând metoda echilibrului electronic.
Alcătuiți ecuații pentru reacțiile acidului azotic: 1 opțiune cu oxid de cupru (II), cu hidroxid de sodiu 2 opțiune cu hidroxid de zinc; silicat de sodiu Actualizarea cunoștințelor Luați în considerare reacțiile din punctul de vedere al TED.
Verificare reciprocă Opțiunea 1 Opțiunea 2 2HNO 3 + Zn(OH) 2 = Zn(NO 3) 2 + 2H 2 O 2H + + 2NO 3 – + Zn(OH) 2 = Zn 2+ +2NO 3 – + + 2H 2 O 2H + + Zn(OH) 2 = Zn 2+ + 2H 2 O 2HNO 3 + Na 2 SiO 3 = ↓ H 2 SiO 3 + 2NaNO 3 2H + + 2NO 3 – + 2Na + + SiO 3 2 – = ↓ H 2 SiO 3 + + 2Na + + 2NO 3 – 2H + + SiO 3 2 – = ↓ H 2 SiO 3 2HNO 3 + CuO = Cu(NO 3) 2 + H 2 O 2H + + 2NO 3 – + CuO = Cu 2+ + 2NO 3 – + H 2 O 2H + + CuO = Cu 2+ + H 2 O HNO 3 + NaOH = NaNO 3 + H 2 O H + + NO 3 – + Na + + OH – = Na + + NO 3 – + H2OH + + OH – = H2O
O proprietate caracteristică a acidului azotic este capacitatea sa de oxidare pronunțată. Acidul azotic este unul dintre cei mai energici agenți oxidanți. Multe nemetale sunt ușor oxidate de acesta, transformându-se în acizii corespunzători. Acidul azotic concentrat (mai mult de 60%) este redus la NO 2, iar dacă concentrația acidului este (15–20%), atunci la NO.
HNO 3 + C → C O 2 + H 2 O + NO 2 N +5 + 1e → N +4 1 C 0 – 4 e → C + 4 4 HNO 3 + P → H 3 PO 4 + NO 2 + H 2 O N +5 + 1e → N +4 P 0 – 5e → P +5 5 Să scriem ecuația reacției și să aranjam coeficienții folosind metoda balanței electronice. HNO 3 (datorită N +5) - agent oxidant, proces de reducere C - agent reducător, proces de oxidare HNO 3 (datorită N +5) - agent de oxidare, proces de reducere P - agent reducător, proces de oxidare Să ne uităm la experimentul 1 Interacțiune a acidului azotic cu carbonul Să ne uităm la experimentul 2 Interacțiunea acidului azotic cu fosforul Să scriem ecuația reacției și să aranjam coeficienții folosind metoda balanței electronice. 4 4 1 4 2 4 1 5 5 1 5 5
Acidul azotic interacționează cu aproape toate metalele, inclusiv cu cele din seria de activitate după N. Profunzimea reducerii azotului în astfel de reacții depinde de concentrația acidului, de activitatea metalului și de temperatură. Scăderea temperaturii promovează o recuperare mai profundă a azotului. Hidrogenul nu este eliberat în reacțiile acidului cu metalele, deoarece acidul azotic își prezintă proprietățile de oxidare nu datorită H +, ci datorită N +5. Acidul azotic la rece concentrat pasivează metalele: Al, Fe, Be, Cr, Ni, Pb și altele (datorită formării unui film dens de oxid). Când sunt încălzite și diluate cu acid azotic, aceste metale se dizolvă în el
Metale active Li Na……. Zn Metale cu activitate medie Cr……….. Sn Metale scăzute și inactive Pb …........ Ag Metale nobile Au Pt Os Ir Conc HNO de 3 ori HNO de 3 ori HNO 3 Conc HNO de 3 ori HNO 3 ori foarte mult HNO 3 Conc HNO 3 ori HNO 3 Sol. numai în amestec de acva regia 3 vol. HCI B 1 voi. HNO 3 NO NO 2 N 2 O sau N 2, NO 2 NH3 NH 4 NO 3 Nu reacționează NO 2, NO, N 2 ONH 3 NO 2, NO, N 2 O, NH 3 NO 2 NO HNO3 concentrat >60% HNO3 diluat = 30-60% HNO3 foarte diluat
1) HN +5 O 3 (conc.) + Cu 0 = Cu +2 (NO 3) 2 + N +4 O 2 + H 2 O 2 2 N +5 + 1e → N +4 Cu 0 – 2e → Cu +2 2) HN +5 O 3 (diluat) + Cu 0 = Cu +2 (NO 3) 2 + N +2 O + H 2 O 3 3 4 2 8 N +5 + 3e → N +2 Cu 0 – 2e → Cu +2 agent oxidant (proces de reducere) Agent reducător (proces de oxidare) 4 Să ne uităm la experimentul 3 „Interacțiunea acidului azotic cu unele metale” Să notăm ecuațiile acestor reacții. 1 2 2 2 1 3 2 6 2 3 agent de oxidare (proces de reducere) agent de reducere (proces de oxidare)
1) HN +5 O 3 (conc.) + Zn 0 = Zn +2 (NO 3) 2 + N +4 O 2 + H 2 O 2 2 N +5 + 1e → N +4 2) HN +5 O 3 (dil.) + Zn 0 = Zn +2 (NO 3) 2 + N -3 H 3 + H 2 O 4 4 3 9 N +5 + 3e → N +2 agent oxidant (proces de reducere) agent reducător (oxidare) proces) 4 agent oxidant (proces de reducere) agent reducător (proces de oxidare) Zn 0 – 2e → Zn +2 1 2 2 2 1 Zn 0 – 2e → Zn +2 3 2 6 2 3
Acidul azotic oxidează multe substanțe organice. Când vine în contact cu pielea, pe ea apar arsuri, iar în cazurile ușoare apar pete galbene. Prin urmare, nu trebuie să lăsați acidul să intre în contact cu pielea sau cu îmbrăcămintea, deoarece țesuturile sunt și ele distruse prin acțiunea sa. Inhalarea vaporilor de acid azotic duce la otrăvire.
Consolidarea materialului studiat Interacțiunea acidului azotic cu metalele Lucrul cu simulatorul
Tema § 19 (p. 54-56), ex. 4,5,7 (pag. 59). Compuneți și echilibrați folosind balanța electronică 3 reacții de interacțiune a acidului azotic cu metalele
Bine făcut! Mulțumesc pentru muncă
Literatură: Chimie clasa a IX-a, Rudzitis G.E., Feldman F.G., ed. Educaţie 20012 Reacţii de oxidare-reducere. Khomchenko G. P., Sevastyanova K. I ed. Iluminismul 2012 A.G. Kuhlman. Chimie generală, Moscova-1989. Resurse de internet: http://school-collection.edu.ru http://fcior.edu.ru