Compania AUTOKAT RECYCLE oferă companiilor și persoanelor fizice oportunitatea de a vinde aceste piese care și-au epuizat durata de viață pentru cost maximîn cel mai scurt timp posibil. Această soluție contribuie la beneficiul clienților și contribuie la aducerea unei contribuții fezabile la conservarea mediului.
Vânzări de catalizatori industriali
– o soluție excelentă care vă permite să câștigați o sumă decentă de bani și să trimiteți piesa pentru reciclare „corespunzătoare”. AUTOKAT RECYCLE este o companie specializata in achizitionarea acestor produse, care dispune de toate resursele necesare, facilitând analiza de înaltă precizie a conținutului elementelor valoroase, datorită cărora clienții pot conta pe evaluarea promptă a costurilor.
Compania noastră desfășoară operațiuni în numeroase orașe din Rusia. Dacă nu există niciun punct cu o locație convenabilă, puteți trimite produsul folosind serviciile de poștă sau curier.
A căror resursă a fost epuizată sau dacă din orice motiv și-au pierdut funcționalitatea, contactați AUTOKAT RECYCLE - o procedură care nu durează practic. După primirea produsului, specialiștii efectuează analizele necesare și calculează suma de plată, iar dacă clientul este mulțumit de acestea, atunci se încheie un acord și se emit bani (sunt posibile non-numerar și alte metode de plată).
Clienților AUTOKAT RECYCLE li se garantează condiții atractive, nu lipsite de beneficii și confort. Astfel, persoanele care decid să predea catalizatorul pot conta pe furnizarea de consultanță competentă, prețuri ridicate, cât mai repede posibil pentru analize si plati. Pe site, vizitatorii pot afla costul aproximativ al unui produs folosind un calculator special, cunoscând conținutul aproximativ de metale prețioase din compoziția sa.
Pe baza compoziției lor, catalizatorii sunt împărțiți în 1) modificați; 2) mixt și 3) pe purtători.
1) Catalizatori modificați. Un modificator este o adăugare la catalizator a unei cantități mici (până la 10–12 % în greutate) dintr-o altă substanță care nu este activă catalitic pentru o anumită reacție, dar îmbunătățește anumite calități ale catalizatorului (rezistență la căldură, rezistență, rezistență la otravă). ). Dacă un modificator crește activitatea, acesta este un promotor. Pe baza naturii acțiunii lor, promotorii sunt împărțiți în a) electronic, provocând deformarea rețelelor cristaline ale catalizatorului sau modificarea funcției de lucru a electronilor în direcția dorită. De exemplu, adăugarea de CI la un catalizator de argint pentru oxidarea metanolului: CH3OH® CH2O; b) stabilizând, prevenind sinterizarea structurii dispersate a catalizatorului. De exemplu, promotorii Al 2 O 3 și SiO 2 stabilizează cristalele primare ale catalizatorului de fier în sinteza amoniacului: N 2 + 3H 2 ® 2NH 3. În prima zi de funcționare, cristalele sunt sinterizate și mărite de la 6 la 20 nm. Furnizarea de energie liberă la interfața cu cristalul scade și activitatea scade. Promotorii introduși, fără a fi restaurați, se topesc la temperatura de sinteză, iar în jurul cristalelor se înfășoară o peliculă subțire, împiedicând sinterizarea acestora. Ambii aditivi au însă o suprafață acidă pe care molecula de NH3 este ferm adsorbită, împiedicând sorbția moleculelor de azot, iar activitatea catalizatorului scade; V) care formează structura, neutralizarea centrilor acizi Al 2 O 3 și SiO 2. De exemplu, K 2 O, CaO și MgO, dar cantitatea lor nu trebuie să fie mai mare de 4-5% în greutate, deoarece au un efect de mineralizare, adică. promovează sinterizarea cristalelor de Fe.
2) catalizatori mixti. Catalizatorii mixți sunt cei care conțin mai multe componente care sunt active catalitic pentru o reacție dată, luați în cantități comparabile. Activitatea unor astfel de catalizatori nu este aditivă, ci capătă o valoare extremă din următoarele motive: formarea amestecurilor mecanice cu o limită de fază mai mare, adică cu o cantitate mare de energie gratuită ( de exemplu, pentru reacţia HCºHC + H2O® CH3-CHO, catalizatorul este un amestec de CdO + CaO/P205 = 3-4; la un raport molar £3, se observă o selectivitate ridicată, dar rezistenţa granulelor de catalizator este scăzută; la ³4 – rezistență mare a granulelor, dar selectivitate scăzută); formarea soluţiilor solide de tip spinel(de exemplu, în catalizatorul de oxidare V 2 O 5 +MoO 3, cationul Mo +6 este introdus în pozițiile libere ale rețelei cristaline V 2 O 5. Deformarea rețelei duce la o creștere a energiei libere a sistemului; formarea de catalizatori noi, mai activi în condiții de reacție(de exemplu, pentru sinteza metanolului CO + 2H 2 ® CH 3 OH, se folosește un catalizator zinc-crom:
ZnO + CrO 3 + H 2 O ® ZnCrO 4 × H 2 O
2ZnCrO 4 ×H 2 O + 3H 2 ® + 5H 2 O
Faza activă obţinută după reducerea catalizatorului, care este în esenţă un catalizator nou, este prezentată între paranteze drepte.
3) Catalizatori suportați. Purtătorul determină forma și dimensiunea granulelor, structura poroasă optimă, rezistența, rezistența la căldură și reducerea costurilor. Uneori crește activitatea (vezi teoria câmpului ligand). Clasificare media: sintetic– silicagel, cărbune activ, oxid de aluminiu (g, a), ceramică; natural– piatră ponce, diatomit; după volumul porilor– poroase (mai mult de 10%), neporoase (10% sau mai puțin); după mărimea boabelor- mari (1-5 mm), mici (0,1-1,0 mm), fin dispersate (mai putin de 0,1 mm); după suprafața specifică– mic (sub 1 m 2 /g), mediu (1-50 m 2 /g), dezvoltat (mai mult de 50 m 2 /g).
Vom cumpăra catalizatori industriali în orice volum în Rostov-pe-Don și regiunea Rostov.
Despre catalizatori
Un catalizator este o substanță chimică care ajută la accelerarea unei reacții. Are o largă aplicație în diverse industrii. Principalii consumatori ai catalizatorului sunt industria de rafinare a petrolului, petrochimica si industria chimica, acestea sunt utilizate cu succes in domeniul ecologiei si protectiei. mediu.
Clasificare
Toate dispozitivele fabricate sunt clasificate:
- După tipul de reacție de cataliză – acid-bază, redox
- După grupa procesului de cataliză - sinteza amoniacului, cracarea produselor petroliere
- După natura bazei active utilizate - metalic, oxid, sulfură, complex și altele
- După metoda de fabricație
Toți catalizatorii folosesc metale neferoase și prețioase: platină, aluminiu, fier, crom, nichel, vanadiu, cobalt, bismut, argint, aur și multe altele.
Catalizatorii industriali sunt, de asemenea, omogene și eterogene. Omogen – se află într-o fază comună cu reactantul. Un catalizator care își formează propria fază, separată de reactanți, se numește heterogen. Folosind catalizatori industriali și de altă natură, nu numai că putem salva natura de substanțele toxice care există în orice producție, ci și materiile prime.
Aplicații industriale

Creșterea rapidă a industriei pe care o vedem acum nu ar fi fost posibilă fără dezvoltarea și apariția unor noi substanțe chimice. procese tehnologice. Progresul este în mare măsură facilitat de utilizarea pe scară largă a catalizatorilor, aceștia ajută la transformarea materiilor prime de calitate scăzută în produse de calitate superioară. Catalizatorul poate fi comparat cu piatra filosofală, despre care se credea că transforma anumite metale în aur. Dar numai catalizatorii transformă materiile prime în diverse medicamente, materiale plastice, chimicale, combustibil, îngrășăminte utile și necesare și alte utilități.
Aplicarea catalizatorilor
Eveniment semnificativ pentru utilizare practică Catalizatorul este considerat începutul producției de margarină prin metoda hidrogenării catalitice a uleiurilor vegetale. Acest lucru a fost realizat pentru prima dată la începutul secolului al XX-lea și deja în anii douăzeci, oamenii de știință au dezvoltat metode catalitice pentru a obține noi materiale organice. Olefinele, nitrilii, esterii și acizii au devenit un fel de „blocuri de construcție” pentru producția de materiale plastice.
Următorul val în care au început să fie utilizați catalizatori industriali a fost rafinarea petrolului. În curând, în acest domeniu al industriei, catalizatorii nu au mai fost necesari, deoarece aceste dispozitive sunt utilizate în toate etapele procesului, cum ar fi:
- Cracare
- Reformare
- Hidrosulfonarea
- Hidrocracare
- Izomerizarea
- Polimerizare
- Alchilare
În ultimii ani, catalizatorii au devenit folosiți pe scară largă în protecția mediului. Cel mai faimos dispozitiv care ne ajută să păstrăm mediul înconjurător este catalizatorul de gaze de eșapament din mașini.
Domeniile de aplicare a neutralizatorilor sunt în continuă expansiune, reacția de cataliză face posibilă îmbunătățirea tehnologiilor dezvoltate anterior. De exemplu, cracarea catalitică a fost îmbunătățită prin utilizarea zeoliților.
Hidrogenarea
Practic, reacțiile catalitice implică activarea unui atom de hidrogen cu o altă moleculă, ceea ce duce la interacțiuni chimice. Acest proces numită hidrogenare, și aceasta este baza pentru multe etape în rafinarea petrolului, precum și în producția de combustibil lichid din cărbune. În timpul războiului, procesul de hidrogenare a fost utilizat pe scară largă în Germania pentru a produce benzină pentru avioane și combustibil pentru mașini din cărbune, deoarece Germania nu are petrol.
Hidrogenarea uleiurilor vegetale comestibile
Încă un lucru proprietate utilă, pe care catalizatorii au în industria alimentară- Aceasta este hidrogenarea uleiului vegetal în margarină, ulei de gătit și alte produse alimentare. În acest caz, pe catalizator sau pe substrat se aplică pulbere fină de nichel.
Dehidrogenare
Această reacție chimică de cataliză este folosită mai rar decât hidrogenarea, dar, cu toate acestea, este și importantă, ajută la obținerea stirenului, propanului, butanului, butenului.
Cataliza acidă
Activitatea majorității catalizatorilor este determinată și depinde de proprietățile lor acide. Catalizatorii industriali acizi sunt utilizați în majoritatea cazurilor în rafinarea petrolului pentru a produce parafine și hidrocarburi aromatice. Cel mai nou lucru în utilizarea catalizatorilor este producția de combustibil cu plumb, precum și tipurile de benzină cu octan ridicat.
Trebuie spus că încă nu există o catalogare unificată a catalizatorilor industriali. Orice merge empiric. Catalizatorii sunt clasificați în funcție de următorii parametri:
- Tip de reacție de cataliză
- Natura substanței care este activă
- Grup de proces catalitic.
Cea mai cuprinzătoare opțiune este a treia, deoarece este cea mai orientată către industria modernă - petrochimică, chimică, rafinarea petrolului.
Istoria creației

Se crede că prima utilizare a unui catalizator a fost producerea de eter etilic din alcool folosind acid sulfuric ca catalizator. În secolul al XVIII-lea a fost descoperită acțiunea catalitică a acidului pentru zaharificarea amidonului. Aici, argila și unele tipuri de metale au fost folosite ca catalizator. Dar totuși, conceptul de „cataliză” nu exista încă. Abia în 1834 Mitscherlich a introdus conceptul de „reacție de contact”. Denumirea „cataliza” a fost propusă de Berzelius un an mai târziu - în 1835.
Folosirea metalului de platină pentru oxidare a fost brevetată în 1831 de omul de știință Phillips, dar pentru uz industrial această metodă nu a primit cataliză din mai multe motive (platina și-a scăzut activitatea atunci când este combinată cu arsen și alte substanțe toxice conținute în gaze). După elaborarea unei metode de curățare diverse gaze din substanțe toxice, a devenit posibil să se creeze primul mare dispozitiv industrial. A fost pus în funcțiune în Rusia în 1897 și brevetat în 1902. Astăzi cel mai important și mari intreprinderi Diverse industrii folosesc „pisici” industriale, iar fiecare proces folosește propriul tip de catalizator, care are o combinație optimă de proprietăți.
Volumul de producție al acestor dispozitive în lume este de peste 800 de mii de tone pe an. Unii dintre catalizatori durează de la 6 luni la un an, în timp ce alții au o durată de viață mult mai lungă - până la 10-12 ani. Odată ce limita de funcționare a fost atinsă, catalizatorul trebuie eliminat în mod corespunzător.
Firma noastra va ofera conditii de vanzare favorabile la preturi optime. Contactați-ne - rețineți că catalizatorii conțin nu numai metale prețioase, ci și substanțe nocive. Nu aruncați dispozitivele în gropile de gunoi, este mai bine să salvați natura și, în plus, puteți obține o sumă bună de bani pentru fier vechi.
Cataliza este una dintre domeniile cu cea mai dinamică și rapidă dezvoltare ale științei și tehnologiei. Sunt dezvoltate în permanență noi sisteme catalitice și cele existente sunt îmbunătățite, sunt propuse noi procese catalitice, designul lor hardware se schimbă, sunt îmbunătățite și apar noi metode fizice și chimice de studiere a catalizatorilor. Majoritatea proceselor chimice implicate în întreprinderile petrochimice și de rafinare a petrolului sunt catalitice. Dezvoltarea tehnologiilor catalitice și catalitice determină în mare măsură competitivitatea produselor petrochimice pe piață. Prin urmare, se pune o întrebare urgentă cu privire la necesitatea formării unor specialiști de înaltă calificare în domeniul catalizei pentru industria petrochimică.
Cataliza este un fenomen specific. Nu există substanțe care să aibă proprietăți catalitice în forma lor generală. Fiecare reacție trebuie să folosească propriul catalizator specific.
Aplicarea catalizei în industria chimică . Procesele catalitice sunt folosite pentru a produce hidrogen, care servește ca materie primă pentru sinteza amoniacului și a unei serii de alte producții de tehnologie chimică. Conversia metanului. Cea mai ieftină sursă de hidrogen este gazul natural. Prima etapă a producerii hidrogenului presupune interacțiunea metanului cu vaporii de apă cu adăugarea parțială de oxigen sau aer la o temperatură de 800 – 1000°C (reacția 2.1). Ca catalizator se foloseste nichelul depus pe suporturi de oxid de aluminiu rezistente la caldura (corindon - a-Al 2 O 3).
CH 4 + H 2 O ⇄ 3H 2 + CO (2,1)
CO + H 2 O ⇄ CO 2 + H 2 (2,2)
Ca rezultat al acestei reacții, monoxidul de carbon se formează în cantități semnificative împreună cu hidrogenul.
conversie CO. Interacțiunea monoxidului de carbon cu vaporii de apă se realizează în două etape la o temperatură descrescătoare folosind catalizatori de oxid (reacția 2.2), care produce suplimentar hidrogen. În prima etapă, s-a folosit un catalizator de fier-crom la temperatură medie (435-475°C) (Fe3O4 cu aditivi Cr2O3); pe al doilea - un catalizator la temperatură scăzută (230-280°C) (un amestec de oxizi de aluminiu, cupru, crom și zinc). Conținutul final de monoxid de carbon, a cărui prezență reduce brusc activitatea catalizatorilor de fier pentru sinteza amoniacului, poate fi redus la zecimi de procent.
Pentru a îndepărta CO rezidual, a fost necesar să se utilizeze spălarea complexă a amestecului de gaze cu o soluție de amoniac de Cu20 la presiune înaltă de 120-320 atm și temperatură joasă de 5-20°C.
În practică producție industrială Purificarea emisiilor de gaze din CO se realizează prin metoda de absorbție a soluțiilor de săruri de Cu-amoniu (formați și carbonați de cupru), care au capacitatea de a forma compuși complecși cu CO. Deoarece formiații nu sunt foarte stabili, se preferă soluțiile de carbonat.
Complexul inițial carbonat-amoniu al cuprului are următoarea compoziție (kmol/m3): Cu + - 1,0 – 1,4; Cu 2+ - 0,08 – 0,12; NH3 – 4,0 – 6,0; CO 2 – 2,4 – 2,6.
Sărurile de cupru monivalente au o capacitate de absorbție pentru CO. Cationii Cu 2+, de regulă, nu participă la absorbție. Cu toate acestea, este necesar să se mențină o concentrație de Cu 2+ în soluție de cel puțin 10 wt. % din conținutul de Cu +. Acesta din urmă ajută la prevenirea formării depunerilor elementare de cupru, care pot înfunda conductele și pot perturba funcționarea absorbantului. Prezența complexului de carbonat de cupru-amoniac Cu 2+ în soluție deplasează echilibrul reacției (1) spre formarea Cu +: Cu 2+ + Cu ⇄ 2 Cu + (1)
Soluția complexului de carbonat de cupru-amoniu utilizată pentru absorbția CO conține 2 CO 3 ; CO3; (NH4)2C03; NH3 liber și CO2.
Procesul de absorbție a CO de către complexul carbonat-amoniu al cuprului se desfășoară conform reacției: + + CO + NH 3 ⇄ + - DH (2)
Concomitent cu CO, CO2 este de asemenea absorbit conform ecuației:
2 NH 3 + H 2 O + CO 2 ⇄ (NH 4) 2 CO 3 - DH 1 (3)
Metanarea.În legătură cu dezvoltarea unui nou catalizator activ de nichel, operația complexă de spălare poate fi înlocuită la 250-350°C cu un proces mai simplu de transformare a reziduului de monoxid de carbon în metan, inert pentru catalizatorul de sinteză a amoniacului (reacția 2.3):
CO + 3H 2 ⇄ CH 4 + H 2 O (2,3)
Astfel, dezvoltarea unui catalizator mai activ a făcut posibilă simplificarea semnificativă schema tehnologicași îmbunătățirea eficienței producției de amoniac.
Aplicarea catalizei în industria de rafinare a petrolului. Eficacitatea utilizării catalizei s-a dovedit a fi atât de semnificativă încât în câțiva ani a avut loc o adevărată revoluție în industria de rafinare a petrolului. revoluție tehnologică, ceea ce a făcut posibilă, prin utilizarea catalizatorilor, creșterea dramatică atât a randamentului, cât și a calității carburanților de motor rezultați.
În prezent, peste 80% din petrol este prelucrat prin procedee catalitice: cracare, reformare, izomerizare și hidrogenare a hidrocarburilor, hidrotratarea fracțiilor petroliere din compuși care conțin sulf, hidrocracare. Tabelul 2.1 prezintă cele mai importante procese catalitice moderne în rafinarea petrolului.
Cracare. Cracarea catalitică a petrolului sau a fracțiilor sale este un proces distructiv, efectuat la temperaturi de 490-540°C pe catalizatori sintetici și naturali de aluminosilicat de natură acidă, pentru a produce benzină de înaltă calitate, cu un număr octanic de 98-92, o valoare semnificativă. cantitatea de gaze care conțin hidrocarburi saturate și nesaturate C 3 - C 4, fracțiuni kerosen-motorină, negru de fumși cola.
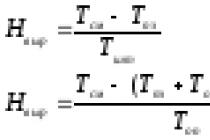
Cifra octanică (O.N.) este un indicator convențional al rezistenței la detonare a combustibililor ușori (benzină, kerosen) atunci când sunt arși în motoarele cu carburator. Combustibilul de referință este izooctanul (U.N. = 100), heptanul normal (U.N. = 0). Cifra octanică a benzinei este procentul (în volum) de izooctan în amestecul său cu n-heptan, care, în condiții standard de testare pe un motor special cu un singur cilindru, detonează în același mod ca și benzina testată.
În ultimii ani, catalizatorii pe bază de zeoliți sintetici cristalini au primit o utilizare industrială pe scară largă. Activitatea acestor catalizatori, în special a celor care conțin un amestec de oxizi ai elementelor pământurilor rare (CeO 2, La 2 O 3, Ho 2 O 3, Dy 2 O 3 și alții), este semnificativ mai mare decât cea a catalizatorilor aluminosilicați amorfi.
Utilizarea catalizatorilor a făcut posibilă nu numai creșterea ratei de formare a hidrocarburilor cu greutate moleculară mai mică din naftene de 500-4000 de ori, ci și creșterea randamentului fracțiilor valoroase în comparație cu cracarea termică.
Cracarea catalitică este procesul catalitic industrial cu cel mai mare tonaj. Cu ajutorul acestuia, în prezent sunt procesate peste 300 de milioane de tone de petrol pe an, ceea ce necesită consumul anual de aproximativ 300 de mii de tone de catalizatori.
Reformare. Reformarea catalitică se efectuează la o temperatură de 470-520°C și o presiune de 0,8-1,5 MPa pe Pt, Re-catalizatori suportați pe oxid de aluminiu tratat cu acid clorhidric pentru a crește proprietățile acide. Reformarea este o metodă de prelucrare a produselor petroliere, în principal benzină și fracții nafta din petrol (hidrocarburi C 6 -C 9 din trei clase principale: parafină, naftenice și aromatice) în scopul obținerii unui nivel octanic ridicat. benzine pentru automobile, hidrocarburi aromatice (benzen, toluen, xilen, etilbenzen) și hidrogen tehnic. În timpul procesului de reformare, apar reacții: dehidrogenarea naftenelor în hidrocarburi aromatice, ciclizarea parafinelor și olefinelor și izomerizarea hidrocarburilor ciclice cu cinci membri în cele cu șase membri. În prezent, reformarea catalitică este utilizată pentru a procesa peste 200 de milioane de tone de petrol pe an. Utilizarea sa a făcut posibilă nu numai îmbunătățirea calității combustibilului pentru motor, ci și producerea unor cantități semnificative de hidrocarburi aromatice pentru industria chimică. Produsele secundare ale reformării catalitice sunt gazul combustibil, constând în principal din metan și etan, precum și gaz lichefiat– fracția propan-butan
Hidrotratarea produselor petroliere. Hidrogenul este un produs secundar valoros al reformării catalitice. Apariția hidrogenului ieftin a făcut posibilă utilizarea pe scară largă a hidrotratării catalitice a produselor petroliere din compuși care conțin sulf, azot și oxigen, cu formarea de H 2 S, NH 3 și, respectiv, H 2 O ușor de îndepărtat (reacții). 2,4 – 2,7):
CS 2 + 4H 2 ⇄ 2H 2 S + CH 4 (2,4)
RSH + H 2 ⇄ H 2 S + RH (2,5)
COS + 4H 2 ⇄ H 2 S + CH 4 + H 2 O (2,6)
RNH + 3/2H 2 ⇄ NH 3 + RH (2,7)
În același timp, are loc hidrogenarea dienelor, ceea ce crește stabilitatea produsului. În acest scop, catalizatorii cei mai folosiți sunt cei preparați din oxizi de cobalt (2–5 % în greutate și molibden (10–19 % în greutate) sau oxizi de nichel și molibden suportați pe γ-alumină.
Hidrotratarea face posibilă obținerea a până la 250-300 de mii de tone de sulf elementar pe an. Pentru a face acest lucru, implementați procesul Claus:
2H 2 S + 3O 2 ⇄ 2SO 2 + 2H 2 O (2,8)
2H 2 S + SO 2 ⇄ 3S + 2H 2 O (2,9)
O parte din H2S este oxidată de oxigenul atmosferic la y-Al203 la 200-250°C (reacția 2.8); cealaltă parte a H 2 S reacționează cu dioxidul de sulf pentru a forma sulf (reacția 2.9).
Condițiile de hidrotratare depind de proprietățile materiei prime care se purifică, dar cel mai adesea se află în intervalul 330-410°C și 3-5 MPa. Aproximativ 300 de milioane de tone de produse petroliere (fracțiuni de benzină și kerosen, motorină, distilate în vid, parafine și uleiuri) sunt supuse anual la hidrotratare. Implementarea etapei de hidrotratare în rafinarea petrolului a făcut posibilă pregătirea materiilor prime pentru reformarea catalitică (benzină) și cracare (distilate în vid), obținerea kerosenului și combustibilului cu conținut scăzut de sulf, îmbunătățirea calității produselor (parafine și uleiuri) și au, de asemenea, un efect semnificativ asupra mediului, deoarece poluarea aerului din emisiile de eșapament este redusă de gaze la arderea combustibilului pentru motor. Introducerea hidrotratării a făcut posibilă utilizarea uleiurilor cu conținut ridicat de sulf pentru obținerea produselor petroliere.
Hidrocracare.ÎN în ultima vreme Procesul de hidrocracare, în care se desfășoară simultan reacțiile de cracare, izomerizare și hidrotratare, a primit o dezvoltare semnificativă. Hidrocracarea este un proces catalitic de conversie profundă a materiilor prime de diverse compoziții fracționate în prezența hidrogenului în vederea obținerii de produse petroliere ușoare: benzină, jet și motorină, gaze lichefiate C 3 -C 4. Utilizarea catalizatorilor polifuncționali permite ca acest proces să fie efectuat la 400-450°C, o presiune de aproximativ 5-15 MPa. Catalizatorii utilizați sunt sulfură de wolfram, catalizatori mixți de sulfură de wolfram-nichel pe suporturi, catalizatori de cobalt-molibden pe oxid de aluminiu, cu adaos de Ni, Pt, Pd și alte metale pe zeoliți amorfi sau cristalini.
Tabel 2.1 – Procese moderne de rafinare catalitică a uleiului
Izomerizarea. Pentru a îmbunătăți calitatea, la benzină se adaugă 10-15% în greutate izomerat cu un număr octanic ridicat. Izomerizatul este un amestec de hidrocarburi alifatice saturate (nu există inele în molecule) cu izostructură (mai mult de 65% în greutate 2-metilbutan; izohexani), obținute prin izomerizarea alcanilor (parafine normale saturate). Materia prima pentru izomerizare este fractiunea usoara de benzina de distilare directa a uleiului, cu fierbere in intervalul 62-85°C si care contine in principal pentan si hexan, precum si fractiunea (75-150°C) obtinuta prin cracare catalitica. Procesele de izomerizare catalitică au loc în prezenţa catalizatorilor bifuncţionali: platină sau paladiu pe diverse suporturi acide (γ-Al 2 O 3, zeolit), promovate de halogen (Cl, F). Izomerizarea este transformarea materie organicăîn compuși cu o structură diferită (izomerie structurală) sau cu o dispunere diferită a atomilor sau grupărilor în spațiu (izomerie spațială) fără modificarea compoziției și greutății moleculare.
Astfel, procesele catalitice ocupă o poziție de lider în rafinarea petrolului. Datorită catalizei, valoarea produselor obținute din ulei a crescut de mai multe ori.
O posibilitate mai promițătoare a metodelor catalitice în rafinarea petrolului este abandonarea transformării globale a tuturor compușilor complecși găsiți în uleiuri, ceea ce este caracteristic proceselor moderne. Astfel, toți compușii cu sulf sunt supuși hidrogenolizei cu eliberarea de hidrogen sulfurat. Între timp, multe dintre ele au o valoare independentă semnificativă. Același lucru este valabil și pentru compușii care conțin azot, complexul metalic și mulți alți compuși. Ar fi foarte important să se izoleze aceste substanțe sau să le supună transformărilor catalitice individuale pentru a obține produse valoroase. Un exemplu este producția de extractanți care conțin sulf, cum ar fi sulfoxizii și sulfonele formate în timpul oxidării catalitice a compușilor cu sulf conținute în ulei și combustibil pentru cazane. Nu există nicio îndoială că în acest fel cataliza va crește semnificativ eficiența rafinării petrolului.
Creșterea industrială rapidă pe care o experimentăm acum nu ar fi fost posibilă fără dezvoltarea de noi tehnologii chimice. În mare măsură, acest progres este determinat de utilizarea pe scară largă a catalizatorilor, cu ajutorul cărora materiile prime de calitate scăzută sunt transformate în produse de mare valoare. Figurat vorbind, catalizator- aceasta este piatra filosofală a alchimistului modern, doar că nu transformă plumbul în aur, ci materiile prime în medicamente, materiale plastice, chimicale, combustibil, îngrășăminte și altele produse sanatoase. Poate, chiar primul proces catalitic pe care omul a învățat să-l folosească este fermentația. Rețetele pentru prepararea băuturilor alcoolice erau cunoscute de sumerieni încă din anul 3500 î.Hr. Vezi VIN; BERE.
O piatră de hotar semnificativă în aplicare practică cataliză devenit producția de margarină hidrogenarea catalitică a uleiului vegetal. Această reacție a fost efectuată pentru prima dată la scară industrială în jurul anului 1900. Și începând cu anii 1920, metodele catalitice de producere nou materiale organice , în special materiale plastice. Punctul cheie a fost producerea catalitică de olefine, nitrili, esteri, acizi etc. – „cărămizi” pentru „construcția” chimică a materialelor plastice. Al treilea val de utilizare industrială a proceselor catalitice datează din anii 1930 şi asociate cu rafinarea petrolului. În ceea ce privește volumul, această producție a lăsat curând pe toate celelalte cu mult în urmă. Rafinarea petrolului constă din mai multe procese catalitice:
cracare,
reformare,
Hidrosulfonarea,
Hidrocracare,
izomerizarea,
Polimerizare
Alchilare.
Și în sfârșit, al patrulea valîn utilizarea catalizei legate de protecția mediului. Cea mai cunoscută realizare în acest domeniu este crearea unui convertor catalitic pentru gazele de eșapament ale automobilelor. Convertizoarele catalitice, care sunt instalate în mașini din 1975, au jucat un rol important în îmbunătățirea calității aerului și, astfel, în salvarea multor vieți.
Aproximativ o duzină de premii Nobel au fost acordate pentru munca în cataliză și domenii conexe. Semnificația practică a proceselor catalitice este evidențiată de faptul că ponderea azot, care face parte din compușii care conțin azot produși industrial, reprezintă aproximativ jumătate din tot azotul inclus în produse alimentare. Cantitatea de compuși de azot produși în mod natural este limitată, astfel încât producția de proteine alimentare depinde de cantitatea de azot adăugată în sol prin îngrășăminte. Ar fi imposibil să hrănești jumătate din umanitate fără amoniac sintetic, care se obține aproape exclusiv folosind catalitic Procesul Haber-Bosch. Domeniul de aplicare al catalizatorilor este în continuă extindere. De asemenea, este important ca cataliza poate crește semnificativ eficiența tehnologiilor dezvoltate anterior. Un exemplu este îmbunătățirea cracarei catalitice prin utilizarea zeoliti.
Hidrogenarea. Număr mare reacțiile catalitice sunt asociate cu activarea unui atom de hidrogen și a unei alte molecule, ducând la interacțiunea lor chimică. Acest proces se numește hidrogenare și stă la baza multor etape ale rafinării petrolului și producției de combustibili lichizi din cărbune ( procesul Bergius). Producția de benzină de aviație și de combustibil din cărbune a fost dezvoltată în Germania în timpul celui de-al Doilea Război Mondial, deoarece această țară nu avea câmpuri petroliere. Procesul Bergius implică adăugarea directă de hidrogen în cărbune. Cărbunele este încălzit sub presiune în prezența hidrogenului pentru a produce un produs lichid, care este apoi procesat în benzină de aviație și combustibil pentru motor. Ca catalizator sunt utilizați oxidul de fier, precum și catalizatorii pe bază de staniu și molibden. În timpul războiului, 12 fabrici din Germania produceau aproximativ 1.400 de tone de combustibil lichid pe zi folosind procesul Bergius. Altul proces, Fischer–Tropsch, constă din două etape. În primul rând, cărbunele este gazeificat, adică. Îl reacționează cu vaporii de apă și oxigenul și obțin un amestec de hidrogen și oxizi de carbon. Acest amestec este transformat în combustibil lichid folosind catalizatori care conțin fier sau cobalt. Odată cu sfârșitul războiului, producția de combustibil sintetic din cărbune în Germania a fost întreruptă. Ca urmare a creșterii prețurilor petrolului care a urmat embargoului petrolului din 1973–1974, au fost depuse eforturi puternice pentru a dezvolta o metodă viabilă din punct de vedere economic de producere a benzinei din cărbune. Astfel, lichefierea directă a cărbunelui poate fi realizată mai eficient utilizând un proces în două etape în care cărbunele este mai întâi contactat cu un catalizator de aluminiu-cobalt-molibden la o temperatură relativ scăzută și apoi la o temperatură mai ridicată. temperatură ridicată. Costul unei astfel de benzine sintetice este mai mare decât cel obținut din petrol.
Amoniac. Unul dintre cele mai simple procese de hidrogenare din punct de vedere chimic este sinteza amoniacului din hidrogen și azot. Azotul este o substanță foarte inertă. Pentru a rupe legătura N-N din molecula sa, este necesară o energie de aproximativ 200 kcal/mol. Cu toate acestea, azotul se leagă de suprafața catalizatorului de fier în stare atomică, iar acest lucru necesită doar 20 kcal/mol. Hidrogenul se leagă și mai ușor de fier. Sinteza amoniacului se desfășoară după cum urmează:
Acest exemplu ilustrează capacitatea unui catalizator de a accelera în mod egal atât reacțiile directe, cât și cele inverse, adică faptul că catalizatorul nu modifică poziția de echilibru a unei reacții chimice.
Hidrogenarea uleiului vegetal. Una dintre cele mai importante în termeni practici reacții de hidrogenare – hidrogenare incompletă a uleiurilor vegetale la margarină, ulei de gătit și alte produse alimentare. Uleiuri vegetale obtinut din boabe de soia, seminte de bumbac si alte culturi. Conțin esteri, și anume trigliceride ale acizilor grași cu diferite grade de nesaturare. Acidul oleic CH 3 (CH 2) 7 CH=CH(CH 2) 7 COOH are o legătură dublă C=C, acidul linoleic are două și acidul linolenic are trei. Adăugarea de hidrogen pentru a rupe această legătură previne oxidarea uleiurilor (râncezirea). Acest lucru crește punctul lor de topire. Duritatea majorității produselor rezultate depinde de gradul de hidrogenare. Hidrogenarea se realizează în prezența unei pulberi fine de nichel depuse pe un substrat sau nichel catalizator Raneyîntr-o atmosferă de hidrogen înalt purificat.
Dehidrogenare. Dehidrogenarea este, de asemenea, o reacție catalitică importantă din punct de vedere industrial, deși amploarea aplicării sale este incomparabil mai mică. Cu ajutorul lui, de exemplu, se obține stirenul, un monomer important. Pentru a face acest lucru, etilbenzenul este dehidrogenat în prezența unui catalizator care conține oxid de fier; Reacția este, de asemenea, facilitată de potasiu și de un fel de stabilizator structural. Dehidrogenarea propanului, butanului și altor alcani se realizează la scară industrială. Dehidrogenarea butanului în prezența unui catalizator de crom-alumină produce butene și butadienă.
Cataliza acidă. Activitatea catalitică a unei clase mari de catalizatori este determinată de proprietățile lor acide. Conform I. Bronsted şi T. Lowry, un acid este un compus care poate dona un proton. Acizii puternici își donează cu ușurință protonii bazelor. Conceptul de aciditate a primit dezvoltare ulterioarăîn lucrări G. Lewis, care a definit un acid ca fiind o substanță capabilă să accepte o pereche de electroni dintr-o substanță donor cu formarea unei legături covalente datorită partajării acestei perechi de electroni.
Aceste idei, împreună cu ideile despre reacțiile care produc ioni de carbeniu, au ajutat la înțelegere mecanismul diferitelor reacții catalitice, în special cele care implică hidrocarburi. Puterea unui acid poate fi determinată utilizând un set de baze care își schimbă culoarea atunci când se adaugă un proton. Se pare că unii catalizatori importanți din punct de vedere industrial se comportă ca acizi foarte puternici. Acestea includ un catalizator Procesul Friedel–Crafts, cum ar fi HCl–AlCl 2 O 3 (sau HAlCl 4) și aluminosilicați. Puterea acidului– asta este foarte caracteristică importantă, deoarece viteza de protonare depinde de ea - etapă cheie proces de cataliză acidă. Activitatea catalizatorilor precum aluminosilicații, utilizați în cracarea petrolului, este determinată de prezența acizilor Bronsted și Lewis pe suprafața acestora. Structura lor este similară cu structura silicei (dioxid de siliciu), în care unii dintre atomii de Si 4+ sunt înlocuiți cu atomi de Al 3+. Excesul de sarcină negativă care apare în acest caz poate fi neutralizat de cationii corespunzători. Dacă cationii sunt protoni, atunci aluminosilicatul se comportă ca Acid Bronsted:
Activitatea catalizatorilor acizi este determinată capacitatea lor de a reacționa cu hidrocarburile pentru a forma ion carbeniu ca produs intermediar. Ionii de alchilcarbeniu conțin un atom de carbon încărcat pozitiv legat de trei grupări alchil și/sau atomi de hidrogen. Ei se joacă rol important ca produşi intermediari formaţi în multe reacţii care implică compuși organici. Mecanismul de acțiune al catalizatorilor acizi poate fi ilustrat prin exemplul reacției de izomerizare a n-butanului la izobutan în prezența HCl–AlCl 3 sau Pt–Cl–Al 2 O 3 . În primul rând, o cantitate mică de olefină C4H8 se leagă de ionul de hidrogen încărcat pozitiv al catalizatorului acid pentru a forma un ion terțiar de carbeniu. Ionul hidrură încărcat negativ H – este apoi separat din n-butan pentru a forma izobutan și un ion secundar de butilcarbeniu. Acesta din urmă, ca urmare a rearanjarii, se transformă într-un ion terțiar de carbeniu. Acest lanț poate continua cu eliminarea unui ion hidrură din următoarea moleculă de n-butan etc.:
Este semnificativ faptul că ionii terțiari de carbeniu sunt mai stabili decât cei primari sau secundari. Ca rezultat, ele sunt prezente în principal pe suprafața catalizatorului și, prin urmare, principalul produs al izomerizării butanului este izobutanul. Catalizatori acizi sunt utilizate pe scară largă în rafinarea petrolului - cracare, alchilare, polimerizare și izomerizare a hidrocarburilor (vezi și CHIMIA ȘI METODE DE PRELUCRARE A ȚEIEI).
Instalat mecanismul de acțiune al ionilor de carbeniu, jucând rolul de catalizatori în aceste procese. Procedând astfel, ei participă la o varietate de reacții, inclusiv formarea de molecule mici prin scindarea celor mari, unirea moleculelor (olefină cu olefină sau olefină cu izoparafină), rearanjarea structurală prin izomerizare și formarea de parafine și aromatice. hidrocarburi prin transfer de hidrogen. Una dintre cele mai recente aplicații ale catalizei acide în industrie este producerea de combustibili cu plumb prin adăugarea de alcooli la izobutilenă sau izoamilen. Adăugarea de compuși care conțin oxigen la benzină reduce concentrația de monoxid de carbon din gazele de eșapament. Metil terț-butil eterul (MTBE) cu un număr octanic de amestec de 109 face, de asemenea, posibilă obținerea combustibilului cu octan mare necesar pentru a funcționa un motor de automobile cu compresie ridicată fără a introduce plumb de tetraetil în benzină. A fost organizată și producția de combustibili cu cifre octanice 102 și 111.
Cataliza de bază. Activitatea catalizatorului este determinată proprietățile lor principale. Demult și bine exemplu celebru astfel de catalizatori sunt hidroxid de sodiu, folosit pentru hidroliza sau saponificarea grăsimilor pentru a produce săpun, iar unul dintre cele mai recente exemple sunt catalizatorii utilizați în producția de materiale plastice și spume poliuretanice. Uretanul se formează prin reacția alcoolului cu izocianatul, iar această reacție este accelerată în prezența aminelor bazice. În timpul reacției, la atomul de carbon din molecula de izocianat se atașează o bază, în urma căreia apare o sarcină negativă asupra atomului de azot și crește activitatea acestuia față de alcool. Trietilendiamina este un catalizator deosebit de eficient. Materialele plastice poliuretanice sunt produse prin reacția diizocianaților cu polioli (polialcooli). Când izocianatul reacţionează cu apa, uretanul format anterior se descompune, eliberând CO 2 . Când un amestec de polialcooli și apă interacționează cu diizocianații, spuma poliuretanică rezultată se formează cu CO2 gazos.
Catalizatori cu dublă acțiune. Acești catalizatori accelerează două tipuri de reacții și produc rezultate mai bune decât trecerea reactanților în serie prin două reactoare, fiecare conținând un singur tip de catalizator. Acest lucru se datorează faptului că situsurile active ale catalizatorului cu dublă acțiune sunt foarte apropiate unele de altele, iar produsul intermediar format pe una dintre ele se transformă imediat în produs final pe cealaltă. Un rezultat bun se obține prin combinarea unui catalizator care activează hidrogenul cu un catalizator care favorizează izomerizarea hidrocarburilor. Activarea hidrogenului Unele metale realizează izomerizarea hidrocarburilor prin acizi. Un catalizator eficient cu dublă acțiune utilizat în rafinarea petrolului pentru a transforma nafta în benzină este platină fin divizată sprijinită pe alumină acidă. Conversia componentelor nafta, cum ar fi metilciclopentan (MCP), în benzen crește numărul octanic al benzinei. La început MCP se dehidrogenează pe partea de platină a catalizatorului într-o olefină cu același schelet de carbon; olefina trece apoi în porțiunea acidă a catalizatorului, unde izomerizează la ciclohexenă. Acesta din urmă trece în partea de platină și este dehidrogenat la benzen și hidrogen. Catalizatorii cu dublă acțiune accelerează semnificativ reformarea uleiului. Ele sunt utilizate pentru izomerizarea parafinelor normale în izoparafine. Acestea din urmă, care fierb la aceleași temperaturi ca fracțiile de benzină, sunt valoroase deoarece au un număr octanic mai mare în comparație cu hidrocarburile simple. În plus, conversia n-butanului în izobutan este însoțită de dehidrogenare, facilitând producerea de MTBE.
Polimerizare stereospecifică. O etapă importantă în istoria catalizei a fost descoperirea polimerizării catalitice a a-olefinelor pentru a forma polimeri stereoregulați. Catalizatorii de polimerizare stereospecifici au fost descoperiți de K. Ziegler când încerca să explice proprietățile neobișnuite ale polimerilor pe care i-a obținut. Un alt chimist, J. Natta, a sugerat că unicitatea polimerilor Ziegler este determinată de stereoregularitatea lor. Experimentele de difracție cu raze X au arătat că polimerii preparați din propilenă în prezența catalizatorilor Ziegler sunt foarte cristalini și au într-adevăr o structură stereoregulată. Pentru a descrie astfel de structuri ordonate, Natta a introdus termenii „izotactic” și „sindiotactic”. În cazul în care nu există ordine, se folosește termenul „atactic”:
La suprafață are loc o reacție stereospecifică catalizatori solizi care conțin metale de tranziție din grupele IVA-VIII (cum ar fi Ti, V, Cr, Zr), care sunt într-o stare incomplet oxidată, și orice compus care conține carbon sau hidrogen, care este asociat cu un metal din grupele I-III. Un exemplu clasic de astfel de catalizator este precipitatul format prin interacțiunea dintre TiCl4 și Al(C2H5)3 în heptan, unde titanul este redus la starea trivalentă. Acest sistem excepțional de activ catalizează polimerizarea propilenei la temperaturi și presiuni normale.
Oxidarea catalitică. Utilizarea catalizatorilor pentru controlul chimiei proceselor de oxidare este de mare știință și semnificație practică. În unele cazuri, oxidarea trebuie să fie completă, de exemplu atunci când se neutralizează contaminanții cu CO și hidrocarburi din gazele de eșapament ale automobilelor. Cu toate acestea, mai des este necesar ca oxidarea să fie incompletă, de exemplu, în multe procese industriale utilizate pe scară largă pentru transformarea hidrocarburilor în produse intermediare valoroase care conțin grupe funcționale precum –CHO, –COOH, –C–CO, –CN. În acest caz, se folosesc atât catalizatori omogene, cât și eterogene. Un exemplu de catalizator omogen este un complex de metal de tranziție care este utilizat pentru a oxida para-xilenul la acid tereftalic, ai cărui esteri formează baza pentru producerea fibrelor de poliester.
Catalizatori pentru oxidarea eterogenă. Acești catalizatori sunt de obicei oxizi solizi complecși. Oxidarea catalitică are loc în două etape. În primul rând, oxigenul din oxid este captat de o moleculă de hidrocarbură adsorbită pe suprafața oxidului. În acest caz, hidrocarbura este oxidată, iar oxidul este redus. Oxidul redus reacționează cu oxigenul și revine la starea inițială. Folosind un catalizator de vanadiu, anhidrida ftalica se obtine prin oxidarea incompleta a naftalinei sau butanului.
Producerea etilenei prin dehidrodimerizarea metanului. Sinteza etilenei prin dehidrodimerizare transformă gazul natural în hidrocarburi mai ușor transportabile. Reacţie
2CH4 + 2O2 → C2H4 + 2H2O
efectuat la 850 °C folosind diferiți catalizatori; cele mai bune rezultate au fost obţinute cu catalizatorul Li-MgO. Probabil că reacția are loc prin formarea unui radical metil prin extracția unui atom de hidrogen dintr-o moleculă de metan. Eliminarea se realizează prin oxigen incomplet redus, de exemplu O 2 2–. Radicalii metil din faza gazoasă se recombină pentru a forma o moleculă de etan și, în timpul dehidrogenării ulterioare, sunt transformați în etilenă. Un alt exemplu de oxidare incompletă este conversia metanolului în formaldehidă în prezența unui catalizator de argint sau fier-molibden.
Zeoliți. Zeoliții alcătuiesc clasă specială de catalizatori eterogene. Aceștia sunt aluminosilicați cu o structură de fagure ordonată, a căror dimensiune celulară este comparabilă cu dimensiunea multor molecule organice. Se mai numesc si ei site moleculare. De cel mai mare interes sunt zeoliții, ai căror pori sunt formați din inele formate din 8-12 ioni de oxigen (Fig. 2). Uneori, porii se suprapun, ca în zeolitul ZSM-5 (Fig. 3), care este folosit pentru conversia foarte specifică a metanolului în hidrocarburi din fracțiunea de benzină. Benzina conține cantități semnificative de hidrocarburi aromatice și, prin urmare, are un număr octanic ridicat. În Noua Zeelandă, de exemplu, o treime din toată benzina consumată este produsă folosind această tehnologie. Metanolul este produs din metanul importat.
Figura 2 – Structura zeoliților cu pori mari și mici.
Figura 3 – Zeolit ZSM-5. Reprezentarea schematică a structurii sub formă de tuburi care se intersectează.
Catalizatorii care alcătuiesc grupul de zeoliți Y măresc semnificativ eficiența cracarei catalitice datorită în primul rând proprietăților lor acide neobișnuite. Înlocuirea aluminosilicaților cu zeoliți face posibilă creșterea randamentului de benzină cu peste 20%. În plus, zeoliții au selectivitate în ceea ce privește dimensiunea moleculelor care reacţionează. Selectivitatea lor este determinată de mărimea porilor prin care pot trece molecule de numai anumite dimensiuni și forme. Acest lucru se aplică atât materiilor prime, cât și produselor de reacție. De exemplu, din cauza restricțiilor sterice, para-xilenul se formează mai ușor decât izomerii orto și meta mai voluminosi. Acestea din urmă se găsesc „blocate” în porii zeolitului (Fig. 4).
Figura 4 - Schema care explică selectivitatea zeoliților în raport cu reactivii (a) și produsele (b).
Utilizarea zeoliților a făcut o adevărată revoluție în unele tehnologii industriale – deparafinare motorină și ulei de mașini, obținerea intermediarilor chimici pentru producerea materialelor plastice prin alchilarea compușilor aromatici, izomerizarea xilenului, disproporționarea toluenului și cracarea catalitică a uleiului. Zeolitul ZSM-5 este deosebit de eficient aici.
Deparafinarea produselor petroliere– extracția parafinei și a cerezinei din produse petroliere (combustibili diesel, uleiuri), în urma cărora calitatea acestora se îmbunătățește, în special, scade punctul de curgere.
Parafină(Germană Parafină, din latină Parum - puțin și affinis - înrudit), un amestec de hidrocarburi saturate C 18 -C 35, în principal. structură normală cu un dig. m. 300-400; cristale incolore cu t pl. = 45–65 o C, densitate 0,880–0,915 g/cm 3 (15 o C).
Ceresin(din latinescul cera - ceară), un amestec de hidrocarburi solide (în principal alchilciclani și alcani), obținut după purificarea ozocheritei. În ceea ce privește densitatea, culoarea (de la alb la maro), punctul de topire (65–88 ° C) și vâscozitatea, ceresina este similară cu ceara.
Catalizatori și protecția mediului. Utilizarea catalizatorilor pentru reducerea poluării aerului a început la sfârșitul anilor 1940. În 1952, A. Hagen-Smith a descoperit că hidrocarburile și oxizii de azot conținute în gazele de eșapament reacționează în lumină pentru a forma oxidanți (în special, ozonul), care irită ochii și dau alte efecte nedorite. Cam în același timp, Yu Houdry a dezvoltat o metodă pentru purificarea catalitică a gazelor de eșapament prin oxidarea CO și hidrocarburi la CO 2 și H 2 O. În 1970, a fost formulată Declarația pentru aer curat (rafinată în 1977, extinsă în 1990). conform căreia toate mașinile noi, începând cu modelele din 1975, trebuie să fie echipate cu convertoare catalitice de evacuare. Au fost stabilite standarde pentru compoziția gazelor de eșapament. Deoarece compușii de plumb adăugați la catalizatorii otrăvitori de benzină, a fost adoptat un program de eliminare treptată. S-a atras atenția și asupra necesității reducerii conținutului de oxizi de azot. Catalizatorii au fost creați special pentru neutralizatorii de automobile, în care ingrediente active aplicat pe un substrat ceramic cu structură de fagure, prin celulele cărora trec gazele de evacuare. Substratul este acoperit strat subțire oxid de metal, de exemplu Al2O3, pe care se aplică un catalizator - platină, paladiu sau rodiu. Conținutul de oxizi de azot formați în timpul arderii combustibililor naturali în centralele termice poate fi redus prin adăugarea unor cantități mici de amoniac în gazele de ardere și trecerea acestora printr-un catalizator de titan vanadiu.
Enzime. Enzimele sunt catalizatori naturali care reglează procesele biochimice dintr-o celulă vie. Ei participă la procesele de schimb de energie, defalcarea nutrienților și reacțiile de biosinteză. Fără ele, multe reacții organice complexe nu pot avea loc. Enzimele funcționează la temperaturi și presiuni obișnuite, au o selectivitate foarte mare și sunt capabile să crească vitezele de reacție cu opt ordine de mărime. În ciuda acestor avantaje, doar aproximativ 20 din cele 15.000 de enzime cunoscute sunt utilizate pe scară largă. Omul a folosit enzime de mii de ani pentru a coace pâine, a produce băuturi alcoolice, brânză și oțet. Acum enzimele sunt folosite și în industrie: în prelucrarea zahărului, în producția de antibiotice sintetice, aminoacizi și proteine. La detergenți se adaugă enzime proteolitice care accelerează procesele de hidroliză. Cu ajutorul bacteriei Clostridium acetobutylicum, H. Weizmann a realizat conversia enzimatică a amidonului în acetonă și alcool butilic. Această metodă de producere a acetonei a fost utilizată pe scară largă în Anglia în timpul Primului Război Mondial, iar în timpul celui de-al Doilea Război Mondial a fost folosită pentru a produce cauciuc butadien în URSS. Un rol extrem de important l-a jucat utilizarea enzimelor produse de microorganisme pentru sinteza penicilinei, precum și a streptomicinei și a vitaminei B12. Alcoolul etilic, produs prin procese enzimatice, este utilizat pe scară largă ca combustibil pentru automobile. În Brazilia, mai mult de o treime din aproximativ 10 milioane de mașini funcționează cu 96% alcool etilic derivat din trestie de zahăr, în timp ce restul funcționează cu un amestec de benzină și alcool etilic (20%). Tehnologia de producere a combustibilului, care este un amestec de benzină și alcool, a fost bine dezvoltată în Statele Unite. În 1987, din boabele de porumb s-au obținut aproximativ 4 miliarde de litri de alcool, din care aproximativ 3,2 miliarde de litri au fost folosiți drept combustibil. Așa-numitele găsesc, de asemenea, diverse aplicații. enzime imobilizate. Aceste enzime sunt legate de un suport solid, cum ar fi silicagel, peste care trec reactivii. Avantajul acestei metode este că asigură contactul eficient al substraturilor cu enzima, separarea produselor și conservarea enzimei. Un exemplu de utilizare industrială a enzimelor imobilizate este izomerizarea D-glucozei la fructoză.
Literatură
1. Gates B.K. Chimia proceselor catalitice. M., 1981
2. Boreskov G.K. Cataliză. Întrebări de teorie și practică. Novosibirsk, 1987
3. Gankin V.Yu., Gankin Yu.V. Nou teorie generală cataliză. L., 1991
4. Tokabe K. Catalizatori și procese catalitice. M., 1993
5. Enciclopedia lui Collier. – Societate Deschisă. 2000.